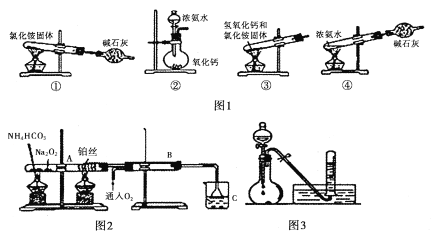
��Ŀ����
����Ŀ��ij��Һ��ֻ�����������е������֣�K+��NH4+��Ba2+��Cl����NO3����SO42������ȡ����100mL��Һ�ֱ��������ʵ�飺
�ٵ�һ�ݼ���ϡ���������������ټ���AgNO3��Һ�г�������
�ڵڶ��ݼ�����NaOH��Һ����ȣ��ռ�������0.04mol
�۵����ݼ�����BaCl2��Һ�ó���4.66g�������ᣬ�����������䡣
��������ʵ�飬�ش��������⣺
(1)��Һ�в���ȷ���Ƿ���ڵ�������_____��һ�����ڵ���������_____
(2)ʵ��ۼ�ӱ�����Һ�в����ڵ�������_____��ʵ��ڷ�����Ӧ�����ӷ���ʽΪ_____
(3)С����������ʵ����Ϊ����Һ��һ�����ڵ�������ΪNH4+��_____���жϵ�������_____��
���𰸡�NO3�� Cl����SO42�� Ba2+ NH4++OH��![]() NH3��+H2O K+ n(Cl��)+2n(SO42��)��n(NH4+)
NH3��+H2O K+ n(Cl��)+2n(SO42��)��n(NH4+)
��������
�ٵ�һ�ݼ���ϡ���������������ټ���AgNO3��Һ�г���������˵����Һ�к���Cl����
�ڵڶ��ݼ�����NaOH��Һ����ȣ��ռ�������0.04mol��˵������NH4����
�۵����ݼ�����BaCl2��Һ�ó���4.66g�������ᣬ�����������䣬˵������SO42������Ba2������n��SO42����=![]() =0.02mol����ϵ���غ�����⡣
=0.02mol����ϵ���غ�����⡣
(1)�����Ϸ�����֪һ������Cl�����Һ���0.02molSO42����0.04molNH4+���ɵ���غ��֪����K+������ȷ���Ƿ���NO3�����ʴ�Ϊ��NO3����Cl����SO42����
(2)ʵ��ۼ�ӱ�����Һ�в����ڵ�������Ba2+��ʵ��ڷ�����Ӧ�����ӷ���ʽΪNH4++OH��![]() NH3��+H2O���ʴ�Ϊ��Ba2+��NH4++OH��
NH3��+H2O���ʴ�Ϊ��Ba2+��NH4++OH��![]() NH3��+H2O��
NH3��+H2O��
(3)��n(Cl��)+2n(SO42��)��n(NH4+)��һ�����ڵ�������ΪNH4+��K+���ʴ�Ϊ��K+��n(Cl��)+2n(SO42��)��n(NH4+)��