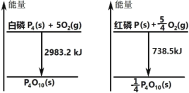
��Ŀ����
����Ŀ������ӵ�����ִ������ܵ�صĴ����������ܵĵ缫���������ʽṹ������ء�
(l) LiFePO4��������õĽṹ�ȶ��Զ���Ϊ��һ���������ϣ�����PO43-�Ľṹ������أ�PO43-�����幹��Ϊ____��P��O��S�ĵ縺�ԴӴ�С��˳��Ϊ______________
(2)ͨ���ڵ缫���ϱ��������̼��������������ǿ�䵼���ԡ�����Ѫ��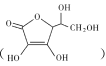 ��������̼������̼Դ����������ˮ��ԭ���� ___������Ѫ����̼ԭ�ӵ��ӻ���ʽΪ ___��1mol����Ѫ��������̼ԭ�ӵ���ĿΪ______
��������̼������̼Դ����������ˮ��ԭ���� ___������Ѫ����̼ԭ�ӵ��ӻ���ʽΪ ___��1mol����Ѫ��������̼ԭ�ӵ���ĿΪ______
(3) Li+�����ѳ�����﮵�ؽṹ̮������O2����ը��ʵ��֤ʵO2����е����Ӷ���Ϊ˳���Է��ӣ����нṹʽ���ڵ�������ӣ������п��ܴ���O2���ӽṹ����____�����ţ���
A. ![]()
B. 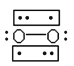
C. ![]()
D. 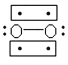
(4)Ŀǰ��õĵ缫��������ܸ����������ʯī��
����ܸ�����������Li��Co��O�ֱ��γ������߲�״�ṹ��ͼa��������Li-O-Co-O-Li�CO-Co-O- Li--˳�����У���û�����Ļ�ѧʽΪ____��Co3+�ļ۲�����Ų�ʽΪ_____��
��ʯī������ͼb������Ϊd pm��C��C����Ϊa pm��ʯī������ܶ�Ϊp g/cm3����ʽ��ʾ�����ӵ�����Ϊ____mol-l��

���𰸡��������� O>S>P �����к��ж���ǻ�������ˮ���Ӽ��γ���� sp2��sp3 2NA B LiCoO2 3d6 ![]()
��������
(l) ���ݼ۲���ӶԻ������ۣ�������������ӵļ۵��Ӷ������ҳ�PO43-�ռ乹�ͣ�P��O��S�ĵ縺�ԴӴ�С��˳�ǽ�����ǿ���͵縺�Դ�С֮��Ĺ�ϵ���ش�
(2)����Ѫ��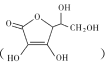 ������ˮ��ԭ���Ӱ���ܽ��Ե����ء������ǻ�������ˮ������������������Ѫ����̼ԭ�ӵ��ӻ���ʽ��̼̼���Ƕȷ�����1mol����Ѫ��������̼ԭ�ӵ���Ŀ��϶����ͼʾ�ṹ�жϣ�
������ˮ��ԭ���Ӱ���ܽ��Ե����ء������ǻ�������ˮ������������������Ѫ����̼ԭ�ӵ��ӻ���ʽ��̼̼���Ƕȷ�����1mol����Ѫ��������̼ԭ�ӵ���Ŀ��϶����ͼʾ�ṹ�жϣ�
(3)�����Ϣ��ʾ��ͼѡ���жϣ�
(4)��Ϣ���ܸ�����������Li��Co��O�ֱ��γ������߲�״�ṹ��ͼa�����þ�̯�����㾧���ڵ�ԭ��������û�����Ļ�ѧʽ���ܵ�ԭ������Ϊ27�������Ų����ɿ�дCo3+�ļ۲�����Ų�ʽ��
����֪ʯī������ͼb������Ϊd pm��C��C����Ϊa pm�����������ܶȵ��ھ�����ܶ�Ϊp g/cm3����ʽ���ӵ�������
(l) PO43-��Pԭ�Ӽ۲���ӶԸ���![]() �Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϿռ乹��Ϊ��������ṹ��
�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������жϿռ乹��Ϊ��������ṹ��
��Ϊ���������壻
Ԫ�صķǽ�����Խǿ����縺��Խ����縺��O>S>P��
����O>S>P��
(2)����Ѫ�� ̼ԭ����Ŀ��Խ��٣��������ں�4���ǻ�������ˮ���Ӽ��γ�����������������ˮ��
̼ԭ����Ŀ��Խ��٣��������ں�4���ǻ�������ˮ���Ӽ��γ�����������������ˮ��
��Ϊ�������к��ж���ǻ�������ˮ���Ӽ��γ������
��������̼̼��������Ӧ̼ԭ��sp3�ӻ���ʽ��Ҳ��̼̼˫������Ӧ̼ԭ��sp2�ӻ���ʽ��
����sp2��sp3��
���ĸ���ͬ��ԭ�ӻ�ԭ����������̼ԭ�ӳ�Ϊ����̼ԭ�ӣ���ͼ֪��1������Ѫ������к�2������̼ԭ�ӣ���1mol����Ѫ��������̼ԭ�ӵ���ĿΪ2NA��
����2NA��
(3)�����Ϣ��O2����е����Ӷ���Ϊ˳���Է��ӣ���ʾ��ͼ֪B�ṹ�л�ѧ����3���ӣ�B�е����ӣ�B���㣻
����B��
(4) ��ܸ�����������Li��Co��O�ֱ��γ������߲�״�ṹ��ͼa���������������ṹ�У�Li����Ϊ��![]() ����Co����Ϊ��
����Co������![]() ��O������
��O����Ϊ��![]() ��Li��Co��O������Ϊ1��1��2����ѧʽΪLiCoO2��
��Li��Co��O������Ϊ1��1��2����ѧʽΪLiCoO2��
����LiCoO2��
�ܵ�ԭ������Ϊ27��Co3+��24�����ӣ������Ų�ʽΪ[Ar] 3d6����۲�����Ų�ʽΪ3d6��
����3d6��
ʯī������̼ԭ����Ŀ=![]() ���ʾ���������=
���ʾ���������=![]() �����ڣ�ƽ���ı��Σ�C��C����Ϊa pm=
�����ڣ�ƽ���ı��Σ�C��C����Ϊa pm=![]() ������ı߳�Ϊ
������ı߳�Ϊ![]() �������ϵĸ�Ϊ
�������ϵĸ�Ϊ![]() ����ı߳�=
����ı߳�=![]() ������Ϊd pm���������=
������Ϊd pm���������=![]() ��
��![]() ��
��![]() =
=![]() ����þ������ܶ�
����þ������ܶ�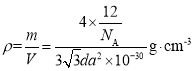 ����NA=
����NA=![]() ��
��
���� ![]() ��
��