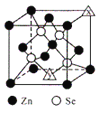
题目内容
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )

A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
【答案】D
【解析】
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应是放热反应,热化学方程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=-117 kJ·mol-1,故A错误;B、物质具有的能量越低越稳定,由图可知 热稳定性: MgI2< MgBr2 < MgCl2 < MgF2,故B错误;C、已知由镁制取氯化镁是放热过程,所以电解熔融氯化镁制取镁单质是是吸热过程,而电解MgCl2溶液不能得到镁单质,故C错误;D、根据图像可知,反应物总能量大于生成物总能量,均为放热反应,ΔH均小于零,能自发进行,故D正确;故选D。
MgCl2(s)+Br2(g) ΔH=-117 kJ·mol-1,故A错误;B、物质具有的能量越低越稳定,由图可知 热稳定性: MgI2< MgBr2 < MgCl2 < MgF2,故B错误;C、已知由镁制取氯化镁是放热过程,所以电解熔融氯化镁制取镁单质是是吸热过程,而电解MgCl2溶液不能得到镁单质,故C错误;D、根据图像可知,反应物总能量大于生成物总能量,均为放热反应,ΔH均小于零,能自发进行,故D正确;故选D。

 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】(1)H3PO2是一元中强酸,写出其电离方程式_______________________________。NaH2PO2为__________(填“正盐”或“酸式盐”),其溶液显__________(填“弱酸性”、“中性”或“弱碱性”)
(2)下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
pH | 1~5 | 6~9 |
SO42-浓度/(mg·L-1) | ≤23000 | ≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为__________mg·L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),__________(填“符合”或“不符合”)国家环保标准。