题目内容
【题目】已知25℃ 时,下列酸的电离常数: 醋酸(CH3COOH):1.75×10-5氢氰酸(HCN) :6.2×10-10,氢氟酸(HF):7.2×10-4,甲酸(HCOOH): 1.77×10-4。下列说法不正确的是( )
A. 物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是:氢氟酸
B. 物质的量浓度均为0.1mol·L-1的CH3COONa和NaF溶液中,CH3COOH 的浓度大于HF的浓度,NaF溶液的pH比CH3COONa溶液大
C. 0.1mol·L-1的HCN和NaCN溶液等体积混合的溶液中:c(CN-)+)
D. 等浓度的NaCN 和HCOONa 混合溶液中:c(OH-)=c(H+)+c(HCN)+c(HCOOH)
【答案】B
【解析】A. 在相同条件下,氢氟酸的电离平衡常数最大,所以,物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是氢氟酸,A正确;B. 在相同条件下,醋酸的电离平衡常数比氢氟酸小,所以,物质的量浓度均为0.1mol·L-1的CH3COONa和NaF溶液中,CH3COONa的水解程度较大,CH3COOH的浓度大于HF的浓度,NaF溶液的pH比CH3COONa溶液小,B不正确;C. 0.1mol·L-1的HCN和NaCN溶液等体积混合的溶液中,c(H+)![]() = 6.2×10-10<10-7,溶液呈碱性,由电荷守恒可知,c(CN-)<c(Na+),B正确;D. 等浓度的NaCN和HCOONa混合溶液中,由质子守恒可知,c(OH-)=c(H+)+c(HCN)+c(HCOOH),D正确。本题选B。
= 6.2×10-10<10-7,溶液呈碱性,由电荷守恒可知,c(CN-)<c(Na+),B正确;D. 等浓度的NaCN和HCOONa混合溶液中,由质子守恒可知,c(OH-)=c(H+)+c(HCN)+c(HCOOH),D正确。本题选B。

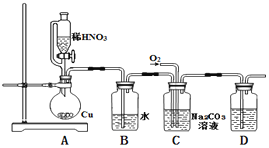
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

请判断A的化学式并说明判断理由:______________________。