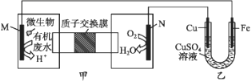
题目内容
【题目】如图为阳离子交换膜法电解精制的饱和食盐水原理示意图。其中阳离子交换膜仅允许Na+通过。下列说法错误的是
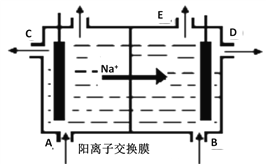
A. 从A口加入精制的浓食盐水
B. 从E口放出的气体是H2
C. D口导出的是含少量氯化钠的NaOH溶液
D. B口NaOH的浓度小于D口
【答案】C
【解析】根据图示Na+的运动方向可知,Na+向阴极移动,左边为阳极区,右边为阴极区。阳极上发生:2Cl─-2e-=Cl2↑,阴极上发生2H++2e-=H2↑,电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,阴极生成OH-,且则产品烧碱溶液从阴极区导出。A.根据分析,应在阳极补充NaCl,从A口加入精制的浓食盐水,故A正确;B.右边为阴极区,阴极上发生2H++2e-=H2↑,故B正确;C.阴极生成OH-,且则产品烧碱溶液从阴极区导出,D口导出的是NaOH溶液,其中没有氯化钠,故C错误;D.为了增大溶液的导电性,B口导入的是稀氢氧化钠溶液,不是纯水,产品烧碱溶液从阴极区导出,D口导出的是浓NaOH溶液,故D正确;故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目