题目内容
12. 如图是一类甲烷燃烧电池示意图.
如图是一类甲烷燃烧电池示意图.(1)B为电池的负极,电极反应为CH4-8e-+10OH-=CO32-+7H2O;
(2)若用该燃料电池作电源,用石墨电极电解100mL 1mol/L CuSO4 的溶液
①写出阳极的电极反应式:4OH--4e-=O2↑+2H2O;
②当某一电极增重0.32g时,电解液pH=0,原电池中理论上消耗CH4 体积在标准状况下为560mL.
分析 (1)燃料电池中的燃料发生氧化反应作负极,所以B是负极,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O;
(2)①电解池的阳极发生氧化反应,是氢氧根离子放电,生成氧气,所以电极反应式为:4OH--4e-=O2↑+2H2O;
②电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有3.2g Cu生成时,转移电子为
$\frac{3.2g}{64g/mol}$×2=0.1mol,阳极上是氢氧根放电,即4OH-→O2↑+2H2O+4e-,当转移0.1mol电子时,则生成氧气的体积为:$\frac{0.1mol}{4}$×22.4L/mol=0.56L=560mL,减少的氢氧根的浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,所以电解后氢离子浓度为1mol/L,从而求出pH.
解答 解:(1)燃料电池中的燃料发生氧化反应作负极,所以B是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(2)①电解池的阳极发生氧化反应,是氢氧根离子放电,生成氧气,所以电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
②电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有3.2g Cu生成时,转移电子为
$\frac{3.2g}{64g/mol}$×2=0.1mol,阳极上是氢氧根放电,即4OH-→O2↑+2H2O+4e-,当转移0.1mol电子时,则生成氧气的体积为:$\frac{0.1mol}{4}$×22.4L/mol=0.56L=560mL,减少的氢氧根的浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,所以电解后氢离子浓度为1mol/L,溶液的pH为0,故答案为:0;560.
点评 本题考查学生原电池和电解原理的有关知识,可以根据所学知识来回答,难度不大.

| A. | 二氧化硫 | B. | 氮气 | ||
| C. | 一氧化碳 | D. | 一氧化氮和硫酸铵 |
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.33 kJ•mol-1,则CH4的燃烧热为802.33 kJ | |
| C. | 稀硫酸与0.1 mol•L-1NaOH溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
| A. | 除去溴苯中的溴单质用氢氧化钠溶液 | |
| B. | 除去硝基苯中的二氧化氮用氢氧化钠溶液 | |
| C. | 除去甲烷中的乙烯用酸性高锰酸钾溶液 | |
| D. | 除去苯中的苯酚用氢氧化钠溶液 |
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
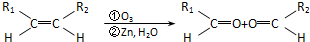
 ③-CH═CH2
③-CH═CH2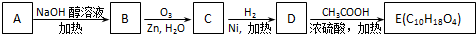
 、
、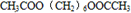 .
.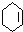
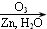
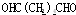 ;
;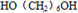 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ .
.