题目内容
10.现有原子序数为1~20元素的元素性质或原子结构如下,按要求回答下列有关问题:(1)元素甲是第3周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的化学式NH4Cl,A中含有的化学键是离子键、共价键.
(2)在第3周期元素的原子半径中(0族除外),元素乙的原子半径最大,写出元素乙的最高价氧化物对应水化物的电子式
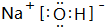 .
.(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是r(Cl-)>r(Ca2+)(用离子符号表示),
元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)元素戊是第3周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物与乙元素的最高价氧化物对应水化物溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
分析 (1)元素甲是第3周期ⅦA族元素,则甲为Cl,甲元素与另两种非金属元素可组成离子化合物A,应是铵盐,即A为氯化铵,含有离子键与共价键;
(2)在第3周期元素的原子半径中(0族除外),元素乙的原子半径最大,则乙为Na,其最高价氧化物对应水化物为NaOH,由钠离子与氢氧根离子构成;
(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则丙为Ca,电子层结构相同的离子,核电荷数越大离子半径越小;
元素丁的原子序数比丙小8,则丁为Mg,Mg在CO2中燃烧生成MgO与碳;
(4)元素戊是第3周期中简单离子半径最小的元素,则戊为Al,该元素的最高价氧化物对应水化物为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水.
解答 解:(1)元素甲是第3周期ⅦA族元素,则甲为Cl,甲元素与另两种非金属元素可组成离子化合物A,应是铵盐,即A为NH4Cl,含有离子键与共价键,故答案为:NH4Cl;离子键、共价键;
(2)在第3周期元素的原子半径中(0族除外),元素乙的原子半径最大,则乙为Na,其最高价氧化物对应水化物为NaOH,由钠离子与氢氧根离子构成,电子式为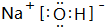 ,故答案为:
,故答案为: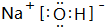 ;
;
(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则丙为Ca,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(Cl-)>r(Ca2+);
元素丁的原子序数比丙小8,则丁为Mg,Mg在CO2中燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:r(Cl-)>r(Ca2+);2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(4)元素戊是第3周期中简单离子半径最小的元素,则戊为Al,该元素的最高价氧化物对应水化物为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查结构性质位置关系综合应用,比较基础,注意对基础知识的理解掌握.

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案①元素种类 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量.
| A. | ①②③⑤ | B. | ①②⑤ | C. | ②⑤⑥ | D. | ①④⑤⑥ |
| A. | 达到平衡时,SO2的浓度与SO3的浓度相等 | |
| B. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 在上述条件下,SO2不可能100%转化为SO3 |
| A. | Z、N的简单离子的还原性:Z2->N- | |
| B. | Y2X和Y2X2都是碱性氧化物 | |
| C. | Z与X形成的化合物对应的水化物一定是强酸 | |
| D. | Z元素的非金属性比N元素的非金属性强 |
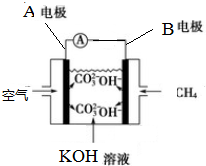 如图是一类甲烷燃烧电池示意图.
如图是一类甲烷燃烧电池示意图.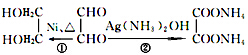 转化的反应方程式.
转化的反应方程式.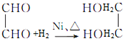 、②
、②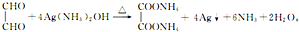 .
.