题目内容
7.下列说法正确的是( )| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.33 kJ•mol-1,则CH4的燃烧热为802.33 kJ | |
| C. | 稀硫酸与0.1 mol•L-1NaOH溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
分析 A、根据化学方程式的书写方法以及气化吸热、液化放热来分析;
B、燃烧热的单位为kJ/mol;
C、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)十OH-(aq)=H2O;△H=一57.3kJ/mol,由此分析解答;
D、固体硫变化为气态硫需要吸收热量;
解答 解:A、在100℃、101kPa条件下,1mol液态水气化时需要吸收40.69kJ的热量,即H2O(l)?H2O(g)△H=+40.69kJ•mol-1,则H2O(g)?H2O(l)的△H=-40.69kJ•mol-1,故A错误;
B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-802.33kJ/mol,则CH4的燃烧热为802.33kJ/mol,故B错误;
C、稀的强酸与强碱生成1molH2O放出的热量为中和热,所以稀硫酸与0.1 mol•L-1NaOH溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,与几元酸无关,故C正确;
D、固体硫变化为气态硫需要吸收热量,固体硫燃烧放出的热量少,但反应热都为负值,所以△H1<△H2 ,故D错误;
故选C.
点评 本题主要考查了反应热的概念、大小比较与计算,难度不大,注意概念的掌握.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
17.下列叙述正确的是( )
| A. | 分子中一定含有共价键 | B. | 共价化合物中可能含有离子键 | ||
| C. | 离子化合物中可能含有共价键 | D. | 离子化合物中只含有离子键 |
18.宋代著名法医学家宋慈 的《洗冤集录》中有-银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法不正确的是( )
| A. | X的化学式为Ag2S | B. | 银针验毒时,空气中氧气得到电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | 每生成1mo1X,反应转移2mo1 e- |
15.300ml 0.01mol/L的FeCl3溶液与200mL 0.06mol/L的KCl溶液中,所含Cl-的物质的量浓度之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
5.物质发生化学变化时,反应前后肯定不发生变化的是:( )
①元素种类 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量.
①元素种类 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量.
| A. | ①②③⑤ | B. | ①②⑤ | C. | ②⑤⑥ | D. | ①④⑤⑥ |
 .为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液.
.为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液. 如图是一类甲烷燃烧电池示意图.
如图是一类甲烷燃烧电池示意图.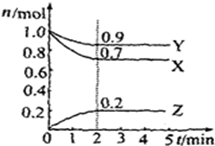 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
 (写结构简式).
(写结构简式). 在一定条件下可水解为
在一定条件下可水解为 和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是 .
.