题目内容
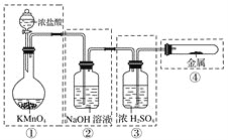
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________,B接__________。
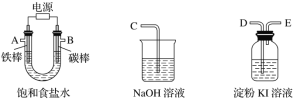
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______________________。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象: __________。
【答案】A接GFI B接DEC 负极 2Cl--2e-=Cl2↑ 淀粉KI溶液变蓝 12 白色沉淀迅速变成灰绿色最后变成红褐色
【解析】
U形管装置为电解装置,铁棒为阴极,连接电源负极,发生还原反应:2H++2e-=H2↑;碳棒为阳极,连接电源正极,发生氧化反应:2Cl--2e-=Cl2↑,所以从A出来的是H2,应该连接G,然后F连接I。淀粉KI溶液可以检验Cl2,所以B连接D,E连接C,目的是吸收尾气Cl2。
(1)根据以上分析可知:A接GFI ,B接DEC ;
答案: A接GFI B接DEC
(2)铁棒不可连接电源正极,如果连接正极铁会失电子,发生氧化反应,所以必须连接电源负极;碳棒为阳极,连接电源正极,发生氧化反应:2Cl--2e-=Cl2↑;
答案:负极 2Cl--2e-=Cl2↑
(3)利用Cl2+2KI=2KCl+I2,碘单质使得淀粉溶液变蓝,证明氯气具有氧化性;
答案:淀粉KI溶液变蓝
(4)2NaCl+2H2O![]() 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
2mol 22.4L
n(NaOH) 5.6×10-3L
n(NaOH)=![]() mol=0.0005mol
mol=0.0005mol
c(NaOH)=![]() =
=![]() =0.01mol/L
=0.01mol/L
pH=-lg![]() =-lg
=-lg![]() =12
=12
答案:12
(5)若将B电极换成铁电极,总电极反应为Fe+2H2O![]() Fe(OH)2↓+H2↑,后续反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此现象为生成白色沉淀,迅速变成灰绿色最后变成红褐色。
Fe(OH)2↓+H2↑,后续反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此现象为生成白色沉淀,迅速变成灰绿色最后变成红褐色。
答案:白色沉淀迅速变成灰绿色最后变成红褐色