题目内容
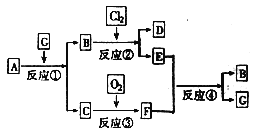
【题目】环己酮是工业上主要用作有机合成的原料和溶剂,可由最简单芳香烃A经如下流程制得:
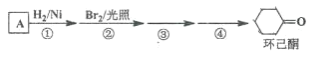
回答下列问题:
(1)反应①的反应类型为_______反应,反应③的反应类型为______。
(2)反应④所用的试剂为_______。
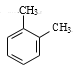
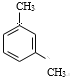
(3)A的同系物(C8H10)所有可能的结构简式为_______。
(4)环己酮的还原产物能与乙酸产生乙酸酯,请写出产生酯的条件。_______
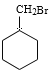
(5)写出A的相邻同系物合成![]() 的合成路线。合成路线常用的表示方式为:______
的合成路线。合成路线常用的表示方式为:______
A![]() B……
B……![]() 目标产物
目标产物
【答案】加成 取代 铜或银作催化剂,O2  、
、 、
、 、
、![]() 浓硫酸、加热
浓硫酸、加热 ![]()
![]()
![]()
![]()
![]()
【解析】
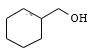
苯与H2在Ni作催化剂、加热反应产生环己烷![]() ,
,![]() 与Br2在光照时发生取代反应产生
与Br2在光照时发生取代反应产生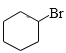 ,
, 与NaOH的水溶液发生取代反应产生
与NaOH的水溶液发生取代反应产生![]() ,
,![]() 在Cu作催化剂、加热时,被O2氧化产生环己酮。
在Cu作催化剂、加热时,被O2氧化产生环己酮。
(1)![]() 与H2在Ni作催化剂、加热反应产生环己烷
与H2在Ni作催化剂、加热反应产生环己烷![]() ,故反应①类型为加成反应,反应③是
,故反应①类型为加成反应,反应③是 中的Br原子被-OH取代产生
中的Br原子被-OH取代产生![]() ,故该反应类型为取代反应;
,故该反应类型为取代反应;
(2)反应④是![]() 在Cu作催化剂、加热时,被O2氧化产生环己酮,故所用的试剂为铜或银作催化剂,O2作反应物,发生催化氧化反应;
在Cu作催化剂、加热时,被O2氧化产生环己酮,故所用的试剂为铜或银作催化剂,O2作反应物,发生催化氧化反应;
(3)A的同系物(C8H10)可能是乙苯,也可能是二甲苯,两个甲基在苯环上可能位于邻位、间位、对位,故所有可能的结构简式为 、
、 、
、 、
、![]() ;
;
(4)环己酮的还原产物是环己醇![]() ,该物质含有醇羟基,能与乙酸在浓硫酸存在和加热时发生酯化反应产生乙酸环己酯,则反应产生酯的条件是浓硫酸、加热;
,该物质含有醇羟基,能与乙酸在浓硫酸存在和加热时发生酯化反应产生乙酸环己酯,则反应产生酯的条件是浓硫酸、加热;
(5) A的相邻同系物是甲苯,以甲苯为原料合成![]() ,首先是催化加氢还原产生
,首先是催化加氢还原产生![]() ,然后
,然后![]() 与Br2在光照时发生取代反应产生
与Br2在光照时发生取代反应产生 ,
, 与NaOH的水溶液共热,发生取代反应产生
与NaOH的水溶液共热,发生取代反应产生 。故合成路线表示为:
。故合成路线表示为:![]()
![]()
![]()
![]()

![]()
 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下表给出七种元素的相关信息,根据以下信息填空:
元素 | 相关信息 |
A | 核外电子数和电子层数相等 |
B | 基态原子2p能级有3个未成对电子 |
C | 在地壳中含量最高 |
D | 目前,在元素周期表中电负性最大 |
E | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
F | 原子序数等于D与E的原子序数之和 |
G | 基态原子2p能级上有两个空轨道 |
(1)写出D在元素周期表中的位置___________________。
(2)14gB的单质分子中π键的个数为____________。
(3)C元素的氢化物的沸点是同族元素氢化物中最高的,原因是________。
(4)B、C、D 3种元素的电负性由大到小的顺序为________(用元素符号表示)。
(5)写出一种与B2互为等电子体的分子或离子____________。
(6)已知BA5为离子化合物,写出其电子式:_______。
(7)第二周期中,第一电离能介于B元素和G 元素间的元素为 ____(填“元素符号”)。