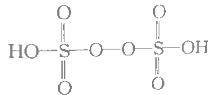
题目内容
【题目】现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五种阴离子为
,五种阴离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现将它们分别配成
现将它们分别配成![]() 的溶液,进行如下实验
的溶液,进行如下实验
![]() 测得溶液A、B呈碱性,且碱性为
测得溶液A、B呈碱性,且碱性为![]() ;
;
![]() 向C溶液中滴加稀盐酸,有气体生成;
向C溶液中滴加稀盐酸,有气体生成;
![]() 向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
请根据上述实验现象,回答下列问题
![]() 实验
实验![]() 中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
![]() 分两步写出实验
分两步写出实验![]() 中发生反应的离子方程式______________。
中发生反应的离子方程式______________。
![]() 写出下列四种化合物的化学式:A______________;B______________。
写出下列四种化合物的化学式:A______________;B______________。
【答案】![]() ; 先出现白色沉淀,迅速变为灰绿色,最终变为红褐色
; 先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 ![]() ↓、
↓、![]()
![]()
![]()
【解析】
根据题意,现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为K+、Ca2+、Ba2+、Fe2+、Al3+,五种阴离子为Cl-、OH-、NO3-、SO42、CO32,现将它们分别配成0.5 mol·L-1的溶液,进行如下实验,测得溶液A、B呈碱性,分析得出溶液显碱性的只能是含OH-的碱和易溶于水的碳酸盐,由于CO32与Ca2+、Ba2+、Fe2+、Al3+不共存,所以碳酸盐只能是碳酸钾,碱只能为氢氧化钡,由于碱性B>A,所以A为K2CO3,B为Ba(OH)2;向C溶液中滴加稀盐酸,有气体生成,不可能是碳酸盐了,那就要思考其他情况,分析得出会发生氧化还原反应而得到NO气体,发生9Fe(NO3)2+12HCl =5Fe(NO3)3+3NO↑+4FeCl3+6H2O反应,说明C物质为Fe(NO3)2,向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失,说明溶液中含有Al3+,结合前面离子分析,D物质为Al2(SO4)3溶液。
⑴向C溶液中滴加稀盐酸,发生反应9Fe(NO3)2+12HCl = 5Fe(NO3)3+3NO↑+4FeCl3+6H2O。向Fe(NO3)2溶液中加入NaOH溶液,先是亚铁离子和氢氧根反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化,迅速变灰绿色,最终变为红褐色,故答案为:9Fe(NO3)2+12HCl = 5Fe(NO3)3+3NO↑+4FeCl3+6H2O,先出现白色沉淀,迅速变为灰绿色,最终变为红褐色;
⑵D为Al2(SO4)3溶液,向Al2(SO4)3溶液中滴加NaOH溶液,Al3+先与OH-反应生成氢氧化铝白色沉淀即Al3++3OH-= Al(OH)3↓,再滴加氢氧化钠溶液,白色沉淀又消失即发生离子反应Al(OH)3+OH-= AlO2-+2H2O,故第一空答案Al3++3OH-= Al(OH)3↓,第二空答案Al(OH)3+OH-= AlO2-+2H2O;
⑶由上面的分析可知,A为碳酸钾,B为氢氧化钡;故第一空答案为K2CO3,第二空答案为Ba(OH)2。

 阅读快车系列答案
阅读快车系列答案【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:![]()
化学键 |
|
|
|
|
| a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的![]() ______
______![]() 用含a、b、c、d的代数式表示
用含a、b、c、d的代数式表示![]() 。
。
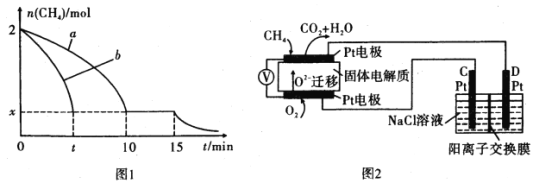
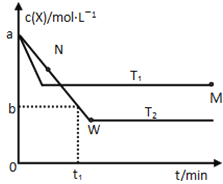
![]() 温度时,向1L的恒容反应器中充入2
温度时,向1L的恒容反应器中充入2![]() ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中![]() min
min![]() 的物质的量随时间变化如图1,测得
的物质的量随时间变化如图1,测得![]() min时
min时![]() 的浓度为
的浓度为![]()
![]() min内
min内![]() 表示的反应速率为______
表示的反应速率为______![]()
![]()
![]() 若图1中曲线a、曲线b分别表示在温度
若图1中曲线a、曲线b分别表示在温度![]() 时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n
时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n![]() 的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a“或“b”)。
的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a“或“b”)。
![]() min时,若改变外界反应条件,导致
min时,若改变外界反应条件,导致![]() 发生图中所示变化,则改变的条件可能是_______
发生图中所示变化,则改变的条件可能是_______![]() 任答一条即可
任答一条即可![]() 。
。
![]() 实验测得:
实验测得:![]() ,
,![]() ,其中
,其中![]() 、
、![]() 为速率常数仅与温度有关,
为速率常数仅与温度有关,![]() 温度时
温度时![]() 与
与![]() 的比值为______(填数值)。若将温度由
的比值为______(填数值)。若将温度由![]() 升高到
升高到![]() ,则反应速率增大的倍数
,则反应速率增大的倍数![]() ______V逆 (选填“
______V逆 (选填“![]() ”、“
”、“![]() ”或“<”)。
”或“<”)。
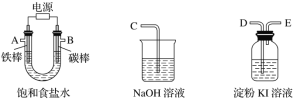
![]() 科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了
科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了![]() 与
与![]() 的固体,可在高温下传导
的固体,可在高温下传导![]()
![]() 极为______极(选填“阳”或“阴”)。
极为______极(选填“阳”或“阴”)。
![]() 该电池工作时负极反应方程式为________。
该电池工作时负极反应方程式为________。
![]() 用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为_________ mol
用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为_________ mol