题目内容
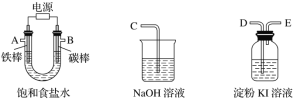
【题目】某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用______________量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为______________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录______________;
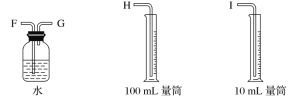
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:______________。
⑵本实验中应选用______________(填序号)的量筒。
A、100 mL B、200 mL C、500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=______________。
⑷简述速率不等的原因______________铜丝不与酸接触的原因______________。
【答案】酸式滴定管 0.12 反应起止时间 将量筒缓缓向下移动,使乙、丙中液面相平 两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气 B 0.2V L/mol 酸的浓度相同时,c(H+)不同 防止形成原电池,干扰实验现象的观察
【解析】
②量取10.00 mL1mol/L盐酸和醋酸溶液,从体积的精确度看,不能使用量筒,只能使用酸式滴定管。答案为酸式滴定管。
③酸为0.01mol,若不考虑镁带表面的氧化镁,其物质的量为0.005mol,质量为0.12g,所以镁带的质量应大于0.12g。答案为0.12。
⑤因为要测定的是不同酸性的酸与镁反应速率的快慢,所以应记录反应起止时间。答案为反应起止时间。
⑥若广口瓶内的液面与量筒内的液面不相平,将存在一个压强差,此时气体的体积与量筒内水的体积不同。答案为:将量筒缓缓向下移动,使乙、丙中液面相平。
(1)检查装置的气密性时,通常采用改变压强、从而产生水柱的方法,压强改变常通过改变温度来实现。答案为:两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气。
(2)![]() ,应选量筒的规格应稍大于112mL。答案为B。
,应选量筒的规格应稍大于112mL。答案为B。
(3)![]() 。答案为0.2V L/mol。
。答案为0.2V L/mol。
(4)盐酸为强酸,醋酸为弱酸,二者电离产生的c(H+)不同,反应速率不同。答案为:酸的浓度相同时,c(H+)不同
若铜丝与酸接触,则镁、铜、酸形成原电池,将会改变镁与酸反应的速率。答案为:防止形成原电池,干扰实验现象的观察。

【题目】在标准状况下进行甲、乙、丙三组实验:三组各取30.0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
产生气体体积/mL | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸______________(选填“适量”“过量”或“不足量”,下同),理由是______________。要算出盐酸的物质的量浓度,题中可作计算依据的数据是______________。求得的盐酸的物质的量浓度为______________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________,求得的Mg、Al的物质的量之比为______________;
(3)在丙组实验之后,向容器中加入1.00 mol·L-1 NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶性固体,求滤液中各溶质的物质的量和所加入NaOH溶液的体积(写计算过程)。___________________