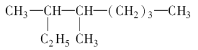��Ŀ����
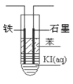
����Ŀ����1����̬��ԭ�ӵļ۵����Ų�ͼΪ
��2����֪TiCl4��ͨ�����������ɫҺ�壬�۵�Ϊ��37�� ���е�Ϊ136�� ����֪TiCl4Ϊ ���壮
��3���������Ѿ�����������Ϊ��״�ۺ���ʽ�����ӣ��ṹ��ͼ��ʾ����������Ti��O��ԭ����֮��Ϊ ��
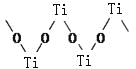
��4��Co��һ��������ľ�����ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ���� �����������Ͽ�ѧ����ʵ����һ������С�鷢������5K�³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ�ӣ��������ô��������ظ��ṹ��Ԫʾ��ͼ��������CoO2�Ļ�ѧ����� ��


��5����C��Mg��Ni����Ԫ����ɵ�һ�ּ������ṹ�Ļ�������г����ԣ��侧����Cλ������λ�ã�Mgλ�ڶ��ǣ�Niռ������λ�ã��û�����Ļ�ѧʽΪ ��������Mgԭ����Χ���������Niԭ���� ���������ͳ������Ͼ�������a=0.38nm������þ�����ܶ� ��gcm��3����������λ��Ч���֣�
��6�������Ѿ����ṹ��ͼ��ʾ������ԭ�ӵİ뾶Ϊr����þ�������ı���ʽΪ

���𰸡���1��![]()
��2�����Ӿ���
��3��1��1��
��4��12��D
��5��MgNi3C�� 12��6.45gcm-3��2�֣�
��6��8 r3��2�֣�
�������������������1��Tiԭ�Ӽ۵���Ϊ3d��4s���ӣ�3d�ܼ�����2�����ӡ�4s�ܼ�����2�����ӣ���۵����Ų�ͼΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��2�����Ӿ����۷е�ϵͣ��������۷е�ϵͣ����ڷ��Ӿ��塣
�ʴ�Ϊ�����ӣ�
��3��ÿ��Oԭ�ӱ�����Tiԭ�ӹ��á�ÿ��Tiԭ�ӱ�����Oԭ�ӹ��ã����þ�̯���������ԭ�Ӹ���֮��Ϊ1��1��
�ʴ�Ϊ��1��1��
��4���������ᄃ���ṹ��֪������Co��Oԭ����Ŀ֮��Ϊ1��1�������ɫ��ΪCoԭ�ӣ��Զ���Coԭ��Ϊ�о�������֮�Ⱦ������������ԭ��λ�����ģ�ÿ������Ϊ8���������ã�ÿ������Ϊ2���������ã��ڸþ�������һ����ԭ�ӵȾ������������ԭ����ĿΪ![]() =12��
=12��
CoO2���ظ��ṹ��Ԫʾ��ͼ��Co��Oԭ����Ŀ֮��ӦΪ1��2����ͼ���֪��A��Co��Oԭ����Ŀ֮��Ϊ1��4��![]() =1��2�����ϣ�B��Co��Oԭ����Ŀ֮��Ϊ��1+4��
=1��2�����ϣ�B��Co��Oԭ����Ŀ֮��Ϊ��1+4��![]() ����4=1��2�����ϣ�C��Co��Oԭ����Ŀ֮��Ϊ4��
����4=1��2�����ϣ�C��Co��Oԭ����Ŀ֮��Ϊ4��![]() ��4��
��4��![]() =1��2�����ϣ�D��Co��Oԭ����Ŀ֮��Ϊ1��4��
=1��2�����ϣ�D��Co��Oԭ����Ŀ֮��Ϊ1��4��![]() =1��1�������ϡ�
=1��1�������ϡ�
�ʴ�Ϊ��12��D��
��5��������̼λ�����ģ�ֻ��1����þλ�ڽ��ϣ�ÿ��þԭ�ӱ�8���������ã���ÿ��������þԭ�Ӹ���Ϊ8��![]() =1������λ�����ģ�ÿ����ԭ�ӱ������������ã���ÿ����������ԭ�Ӹ���Ϊ6��
=1������λ�����ģ�ÿ����ԭ�ӱ������������ã���ÿ����������ԭ�Ӹ���Ϊ6��![]() =3�����ʾ��廯ѧʽΪMgNi3C��ÿ��������þ��Χ��3����ԭ�ӣ�ÿ��þ���˸��������ã��Ϸ����ĸ���������������ԭ�ӣ��ԳƵ��·�Ҳ��������һ��12����
=3�����ʾ��廯ѧʽΪMgNi3C��ÿ��������þ��Χ��3����ԭ�ӣ�ÿ��þ���˸��������ã��Ϸ����ĸ���������������ԭ�ӣ��ԳƵ��·�Ҳ��������һ��12����
������ܶȣ���=![]() ��
��
�ʴ�Ϊ��MgNi3C��12��6.45gcm-3��
��6�������Ѿ����ṹ��ͼ��ʾ������ԭ�ӵİ뾶Ϊr����þ����߳�ԼΪ2r������������ı���ʽΪ(2r)3=8r3��
�ʴ�Ϊ��8r3��

 ȫ��������ϵ�д�
ȫ��������ϵ�д�����Ŀ��������ij��ѧ��ȤС���ͬѧѧϰԪ��������ʱ��Ƶ�����ʵ�鷽����
��ʵ��һ��ʵ�鲽�����£�
ʵ����� | ʵ�鲽�� |
�� | �����Ƶ�Na2S��Һ�еμ����Ƶ���ˮ |
�� | ��þ��Ͷ��1mol/L��ϡ������ |
�� | ������Ͷ��1mol/L��ϡ������ |
��1����Ƹ�ʵ�鷽����Ŀ���ǣ�̽��ͬ����Ԫ�ص�__________________________��
��2��ʵ��ٵ������� ����Ӧ�Ļ�ѧ����ʽ�� ��
��ʵ����� Ϊ��֤Cl2��Br2�ķǽ�����ǿ�������������ʵ�飺(�ɹ�ѡ����Լ��У���ˮ����ˮ��NaCl��Һ��NaBr��Һ���ƾ������Ȼ�̼)ʵ�鲽������ͼ��
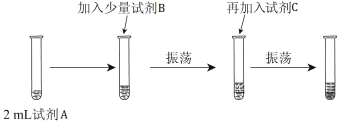
��3���Լ�A�� ���Լ�B�� ���Լ�C�� ��
��4���Լ�C��ʵ��������������� ������C�����ú��������ǣ� �����Ϸ�Ӧ����֤��Cl2�ķǽ�����_______(�ǿ�ڡ������ڡ�)Br2�ķǽ����ԣ���Ӧ�����ӷ���ʽΪ��_______________��