题目内容
【题目】如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍。
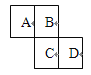
(1)写出A、B、C、D的元素符号:A 、B 、
C 、D 。
(2)A、B、C、D的气态氢化物最不稳定的是(写化学式) 。
(3)A、D两元素的气态氢化物相互反应的化学方程式为 ,现象为 ,产物为 化合物(填“离子”或“共价”)。该化合物中存在的化学键有 (填“离子键”或“共价键”)。
(4)写出下列电子式:
D的气态氢化物 ,A单质 。B的气态氢化物的形成过程用电子式表示: 。
【答案】(1)N、O、S、Cl
(2)H2S
(3)NH3+HCl=NH4Cl;产生白烟;离子;离子键和共价键
(4)![]() ;
;![]() ;
;![]()
【解析】试题分析: A、B、C、D均为短周期元素,根据其位置可判断A和B是第二周期元素,C和D是第三周期元素。设A的原子序数是x,则B是x+1、C是x+9,D是x+10,A与D原子序数之和是C的原子序数的1.5倍,所以x+x+10=1.5×(x+9),解得x=7,所以A、B、C、D分别是N、O、S、Cl。
(1)根据以上分析可知A、B、C、D的元素符号分别是N、O、S、Cl。
(2)四种元素中S元素的非金属性最弱,非金属性越强,氢化物越稳定,所以A、B、C、D的气态氢化物最不稳定的是H2S。
(3)A、D两元素的气态氢化物分别是氨气和氯化氢,相互反应的化学方程式为NH3+HCl=NH4Cl,现象为产生白烟,产物氯化铵为离子化合物。该化合物中存在的化学键有离子键和共价键。
(4)D的气态氢化物是氯化氢,含有共价键的共价化合物,电子式为![]() ,氮气的电子式为
,氮气的电子式为![]() ,B的气态氢化物是水,含有共价键的共价化合物,形成过程用电子式表示为
,B的气态氢化物是水,含有共价键的共价化合物,形成过程用电子式表示为![]() 。
。

【题目】下表是元素周期表的一部分,所列字母分别代表一种元素:
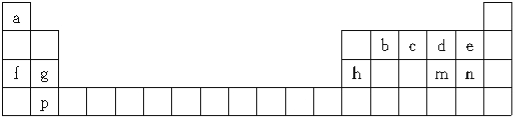
(1)m元素在周期表中的位置是 。
(2)下列有关说法正确的是 (填字母)。
A.b、c、d元素的非金属性逐渐增大 |
B.f、g、h元素的原子半径逐渐减小 |
C.md2与bd2的化学性质类似,都具有氧化性 |
D.e、n的最高价含氧酸的酸性强弱:e>n |
E.a、f分别与d组成的化合物中所含化学键类型完全相同
F.该表中只有4种元素组成的单质具有导电性
(3)a、c、n按原子个数比为4:1:1构成的化合物是 。