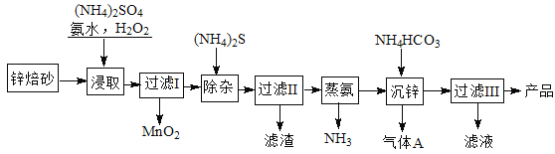
题目内容
【题目】[化学—选修3:物质结构与性质]
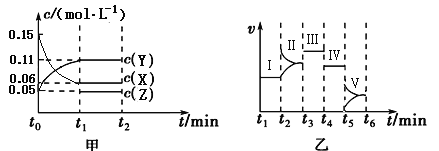
已知X和Y均为短周期元素,其原子的第一至第五电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 |
X | 801 | 2427 | 3660 | 25026 | 32827 |
Y | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
根据上述信息:
①X和氯元素形成的简单分子的空间构型为 。
②Y的基态原子的核外电子排布式为 ,若Y和氯元素形成的分子的相对分子质量为267,请在下列方框中写出该分子的结构式(若存在配位键,用“→”表示)

(2)碳元素可以形成多种单质及化合物:
①C60的结构如图1。C60中的碳原子的杂化轨道类型是 ;


解释:②金刚石中的C-C的键长大于C60中C-C的键长的原因是 ;
③金刚石的熔点高于C60的原因是 ;
(3)如图2是钾的石墨插层化合物的晶胞图(图中大球表示K原子,小球表示C原子),如图3是晶胞沿右侧方向的投影.

①该化合物的化学式是 ;
②K层与C层之间的作用力是 ;
③K层中K原子之间的最近距离是C-C键的键长dC-C的 倍
(4)SiC的晶胞与金刚石的晶胞相似,设碳原子的直径为a cm,硅原子的直径为b cm,则晶胞的边长为 cm(用含a、b的式子表示)。
【答案】(1)① 平面正三角形。② 1s22s22p63s3,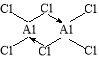
(2)① sp2杂化;② 金刚石中的C—C键为单键,而C60中每个碳原子都以sp2的形式杂化,其2p轨道上还有一个单电子轨道垂直于sp2杂化轨道的平面,相互之间肩并肩重合形成π键,故金刚石中的C-C的键长大于C60中C-C的键长;③ C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,融化时平破坏的是共价键。
(3)① C8K;② 离子键;③ 2;
(4) 。
【解析】
试题分析:
(1)X和Y均为短周期元素,其原子的第一至第五电离能,原子多于5个电子。又由于X、Y都是I4远大于I3,说明最外层都是3个电子。X、Y元素的原子的I1,X大于Y的,故X是B,Y是Al。①X(B)和氯元素形成的简单分子BCl3的中心原子B原子的价层电子无孤电子对,所以其空间构型为平面正三角形;② Y(Al)的基态原子的核外电子排布式为1s22s22p63s3,Y和氯元素形成的分子的相对分子质量为267,其分子是Al2Cl6,Al原子3p有3个单电子,与3个Cl原子形成共价键,还有1个空轨道,可以接收Cl原子提供的孤对电子形成配位键,故其结构式是 。
。
(2)①C60中的每一个碳原子都与3个相邻的碳原子以共价键相结合,故碳原子轨道以 sp2的形式杂化;
②金刚石中的C-C键为单键,而C60中的每个碳原子都以sp2的形式杂化,其2p轨道上还有一个单电子轨道垂直于sp2杂化轨道的平面,相互之间肩并肩重合形成π键,故金刚石中的C-C的键长大于C60中C-C的键长;
③C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,熔化时破坏的是共价键。
(3)①根据均摊法:晶胞中的原子数目分别为K:4×(顶角)+4×(面上)+5(体心)=1+2+5=8,C:4×[8×(面上)+12(体心)]=4×16=64。原子数目这比K:C=8:64=1:8,故该化合物的化学式是C8K;②K属于活泼金属元素,C为非金属元素,二者之间的作用力为离子键;③设晶胞沿右侧方向的投影的边长是2a,宽为a,则K层中K原子之间的最近距离为a,正六边形的内角为120℃,则4dC-C·cos30°=a,故a=2dC-C;
(4)碳化硅的晶胞与金刚石的晶胞相似(如图),碳原子与硅原子最近距离为晶体体对角线的,若晶胞的边长为lcm,则晶体体对角线为lcm=4×(+),故l=。