题目内容
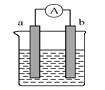
【题目】(一)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
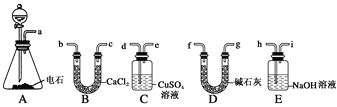
(1)A中制取乙炔的化学反应方程式为______________________。
(2)制乙炔时,旋开分液漏斗的活塞,使水缓慢滴下的原因是________________________,
通常用 代替蒸馏水.
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用________(填序号,下同)装置,气体应从________进;干燥乙炔最好选用________装置。
(4) 制取乙炔时,为防止产生的泡沫涌入导气管,应 操作
(二)溴乙烷性质的探究:
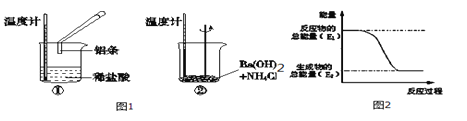
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
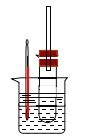
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(1)观察到___________现象时,表明溴乙烷与NaOH溶液已完全反应。
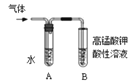
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是 ,若无A试管,B试管中的试剂应为 。
【答案】(一)(1)CaC2+2H2O―→C2H2↑+Ca(OH)2
(2)控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管;饱和食盐水
(3)C d D
(4)应在导气管附近塞入少量棉花
(二)(1)液体不分层(均匀溶液)
(2)吸收乙醇;溴水
【解析】
试题分析:(一)(1)电石与水反应即生成乙炔,化学方程式为CaC2+2H2O―→C2H2↑+Ca(OH)2。
(2)由于电石与水反应很剧烈,所以必须控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管,所以使水缓慢滴下。由于反应非常剧烈,通常用饱和食盐水代替蒸馏水。
(3)H2S、PH3等杂质可以利用CuSO4除去,即选择C装置;除杂时应是长口进,短口出,即从d口进气;碱石灰的干燥能力强于氯化钙的,选择碱石灰,即选择D装置。
(4)制取乙炔时,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
(二)(1)溴乙烷难溶于水,溴乙烷中加入NaOH溶液并水浴加热,溴乙烷发生取代反应生成乙醇和NaBr,生成物均溶于水,则观察到液体不分层现象时,表明溴乙烷与NaOH溶液已完全反应。
(2)要证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,需要证明有乙烯生成,乙醇易挥发且具有还原性,乙烯和乙醇均能使高猛酸钾溶液褪色,所以先除乙醇,则A试管中的水的作用是吸收乙醇,乙醇和溴水不反应,但乙烯能使溴水褪色,若无A试管,B试管中的试剂应为溴水。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据
化学键 | P—P | P—O | O=O | P=O |
键能 kJ·mol-1 | 197 | 360 | 499 | X |
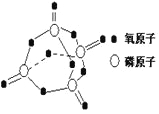
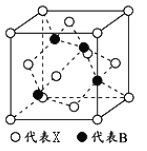
己知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0kJ ,且白磷分子结构为正四面体,4 个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如上图所示,则上表中X为
A.434 B.335 C.237 D.188
【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。