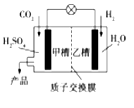
题目内容
【题目】某研究小组为探究不溶性固体X的组成和性质,进行了如下实验。已知X是一种仅含有四种元素的具有固定成的盐类物质,H由碘元素和另外一种元素组成,图中所有气体体积均在标准状况下测定。
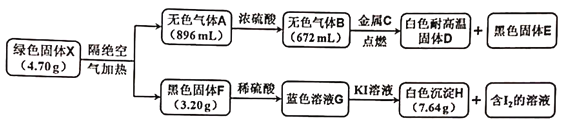
请回答下列问题:
(1)写出X的化学式__________;
(2)写出C的原子结构示意图___________;组成E元素的某种核素常用于考古断代,该原子核内中子数为8,写出该校素的原子符号___________。
(3)C在装有B的集气瓶中燃烧,其实验现象为___________;并写出相应的化学方程式___________。
(4)已知H能与含NaClO的碱性溶液反应生成NaIO3和蓝色絮状沉淀,试写出该反应的离子方程式____________________________。
【答案】Cu(OH)2·3CuCO3 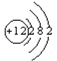 146C 剧烈燃烧,发出耀眼白光,产生白烟,有黑色固体生成 2Mg+CO2
146C 剧烈燃烧,发出耀眼白光,产生白烟,有黑色固体生成 2Mg+CO2![]() 2MgO+C 2CuI+7ClO-+2OH-+H2O=2Cu(OH)2+2IO3-+7Cl-
2MgO+C 2CuI+7ClO-+2OH-+H2O=2Cu(OH)2+2IO3-+7Cl-
【解析】
绿色固体X隔绝空气加热得到无色气体A,通过浓硫酸变为无色气体B,减少的为生成的水蒸气,金属C与B反应生成白色耐高温固体D和黑色固体E,推断D为MgO,E为C,则C为Mg,B为CO2;分解生成的黑色固体F加入稀硫酸反应得到蓝色溶液G为硫酸铜溶液,则黑色固体F为CuO,蓝色溶液G加入KI溶液反应生成白色沉淀H和含I2的溶液,结合氧化还原反应得到碘离子被铜离子氧化为碘单质,铜离子被还原为CuI,H为CuI,结合元素守恒计算分析判断X的化学式。
绿色固体X4.70g隔绝空气加热得到无色气体A的体积896mL,通过浓硫酸无色气体B体积为672mL,减少的为生成的水蒸气,体积=896mL-672mL=224mL,金属C在无色气体B中点燃反应生成白色耐高温固体D和黑色固体E,推断D为MgO,E为C,则C为Mg,B为CO2,物质的量n(CO2)=0.672L÷22.4L/mol=0.03mol,n(H2O)=0.224÷22.4L/mol=0.01mol,分解生成的黑色固体F质量为3.20g,加入稀硫酸反应得到蓝色溶液G为硫酸铜溶液,则黑色固体F为CuO,其物质的量n(CuO)=3.20g÷80g/mol=0.04mol,蓝色溶液G加入KI溶液反应生成白色沉淀H7.64g,和含I2的溶液,结合氧化还原反应得到碘离子被铜离子氧化为碘单质,铜离子被还原为CuI,H为CuI,其物质的量n(CuI)=7.64g÷191g/mol=0.04mol,则X组成元素为Cu、C、H、O元素,其中4.70gX中含C元素物质的量0.03mol,H元素物质的量=0.01mol×2=0.02mol,Cu元素物质的量=0.04mol,氧元素物质的量=(4.70g-0.03mol×12g/mol-0.02mol×1g/mol-0.04mol×64g/mol)÷16g/mol=0.11mol,n(Cu):n(H):n(C):n(O)=0.04:0.02:0.03:0.11=4:2:3:11,化学式Cu4H2C3O11,分解产物分析得到化学式为Cu(OH)2·3CuCO3;
(2)镁的原子序数是12,则Mg的原子结构示意图为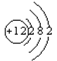 ;组成E元素的某种核素常用于考古断代,该元素是碳元素,该原子核内中子数为8,则质量数是6+8=14,因此该核素的原子符号为146C;
;组成E元素的某种核素常用于考古断代,该元素是碳元素,该原子核内中子数为8,则质量数是6+8=14,因此该核素的原子符号为146C;
(3)镁在装有二氧化碳的集气瓶中燃烧,反应的化学方程式为2Mg+CO2![]() 2MgO+C,则其实验现象为剧烈燃烧,发出耀眼白光,产生白烟,有黑色固体生成;
2MgO+C,则其实验现象为剧烈燃烧,发出耀眼白光,产生白烟,有黑色固体生成;
(4)已知H能与含NaClO的碱性溶液反应生成NaIO3和蓝色絮状沉淀,沉淀是氢氧化铜,碘元素被氧化为碘酸根离子,则该反应的离子方程式为2CuI+7ClO-+2OH-+H2O=2Cu(OH)2+2IO3-+7Cl-。