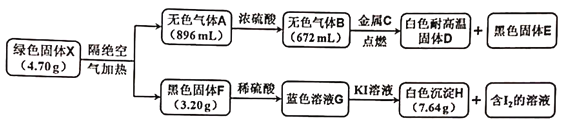
题目内容
【题目】工业上常用硫铁矿(FeS2)焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
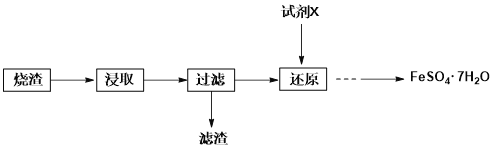
(1)试剂X可能为______________。
A.双氧水 B.酸性高锰酸钾 C.浓硫酸 D.SO2
(2)从还原后溶液中得到产品,应进行的操作是___________、____________、过滤、洗涤、干燥。
(3)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成500 mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,逐渐滴加0.0500 mol/L的酸性KMnO4溶液,至恰好完全反应,记录消耗的酸性KMnO4溶液的体积(假定药品中其他成分不与酸性KMnO4反应);
步骤c:重复步骤b2~3次,平均消耗酸性KMnO4溶液20.00mL。
已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则该补血剂中亚铁离子的含量为_____mg/片。
【答案】D 蒸发浓缩 降温结晶 560
【解析】
由于是制备绿矾,则烧渣中应加入稀硫酸浸取,得到硫酸铁、硫酸亚铁,二氧化硅不反应,过滤,滤渣为二氧化硅,在滤液中加入试剂X,还原硫酸铁得到硫酸亚铁溶液,溶液经蒸发结晶、过滤、洗涤、干燥,可得到FeSO47H2O,以此解答该题。
(1)试剂X用来还原溶液中的铁离子,又因为不能引入新杂质,则X可以选择二氧化硫,铁离子与二氧化硫反应生成硫酸根离子和亚铁离子,选项ABC均能氧化亚铁离子,答案选D。
(2)由于硫酸亚铁能溶于水,则从还原后溶液中得到产品,应进行的操作是蒸发浓缩、降温结晶、过滤、洗涤、干燥。
(3)根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知25mL溶液中:n(Fe2+)=5n(MnO4-)=5×0.0500mol/L×0.0200L=0.00500 mol,则500 mL溶液中:n(Fe2+)=0.00500 mol×20=0.100 mol,1片补血剂样品中n(Fe2+)=0.0100 mol,m(Fe2+)=0.0100mol×56g/mol=0.56g=560mg,即该补血剂中亚铁离子的含量为560 mg/片。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】从元素化合价和物质类别两个角度研究物质的性质,是一种行之有效的方法。以下是铁元素组成物质的二维图的部分信息。
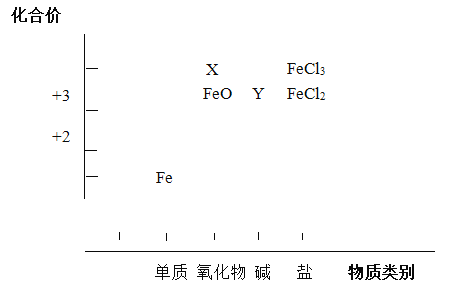
(1)分别写出X、Y的化学式______、______。
(2)写出FeO与稀硫酸反应的化学方程式____________。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的反应的离子方程式。
| 离子方程式 |
氧化性 | ____________________ (一个即可) |
还原性 | ____________________ (一个即可) |
(4)某同学预测Fe3+可以与S2-发生反应,为验证预测,他结合资料信息,选择了两种试剂进行实验,确认了反应的发生。
资料:部分硫化物的溶解性表(室温)
阴离子 阳离子 | S2- |
Na+ | 溶 |
Fe3+ | 不 |
Fe2+ | 不 |
选取的试剂是______和______;可能发生的两种不同原理的反应的离子方程式是:_________、__________。
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2 的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4 的 |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是碳酸钾 |
D | 将碳酸氢铵受热分解产生的气体通入某溶液 | 溶液变浑浊,继续通入该气体,浑浊消失 | 该溶液是氢氧化钙溶液 |
A. AB. BC. CD. D
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。