题目内容
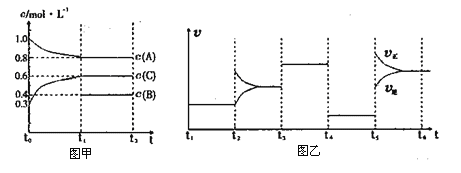
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的价电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是( )

A. 原子半径:b>c>a>d B. 气态氢化物热稳定性:a>d
C. d的氧化物常用于太阳能电池 D. 工业上电解c的氯化物冶炼单质c
【答案】B
【解析】
由短周期元素a、b、c、d的原子序数依次增大,a和b的价电子数之和等于c和d的最外层电子数之和等信息可知a、b、c、d四种元素依次为氧、钠、铝、硅,据此分析可得结论。
A.因同周期元素原子半径逐渐从左至右逐渐增大,同主族元素原子半径从上至下逐渐增大,则有原子半径b>c>d>a,故A错误;B.因氧元素的非金属性大于硅,则有气态氢化物热稳定性H2O>SiH4,故B正确;C. 常用于太阳能电池的是晶体硅,并不是二氧化硅,故C错误;D.因氯化铝为共价化合物,工业上常电解c的氧化物冶炼单质铝,故D错误;答案选B。

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2 的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4 的 |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是碳酸钾 |
D | 将碳酸氢铵受热分解产生的气体通入某溶液 | 溶液变浑浊,继续通入该气体,浑浊消失 | 该溶液是氢氧化钙溶液 |
A. AB. BC. CD. D
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D