题目内容
【题目】(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点的现象是___。
(2)硫代硫酸钠晶体(Na2S2O3.5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100ml溶液 ②滴定:取0.0090mol/LK2Cr2O7的标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应K2Cr2O+6KI+7H2SO=Cr2(SO)+7H2O+3I+4K2SO,然后用硫代硫酸钠样品溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。加入淀粉溶液作为指示剂,继续滴定,到终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___(保留1位小数)。
(3)已知:常温下,醋酸的电离平衡常数为1×10-6,则0.01mol/L的醋酸钠溶液的pH=___,水电离出的c(H+)=___。
【答案】滴入最后一滴标准盐酸溶液,溶液由红色变为无色,且半分钟内不变色 90.0% 9 1×10-5mol/L
【解析】
在醋酸钠溶液中,醋酸根离子发生水解,溶液中的OH-全部来自水电离;不管是酸溶液、碱溶液还是盐溶液,由水电离产生的c(OH-)、c(H+)一定相等。
(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点时,盐酸过量一滴,溶液由红色变为无色,且在半分钟内不变色;
答案为:滴入最后一滴标准盐酸溶液,溶液由红色变为无色,且半分钟内不变色。
(2)设0.0090mol/LK2Cr2O7的标准溶液20.00mL,消耗Na2S2O3的物质的量为x
K2Cr2O7——3I——6Na2S2O3
1mol 6mol
0.0090mol/L×0.02L x
X=0.0090mol/L×0.02L×6=0.00108mol,
样品的纯度为: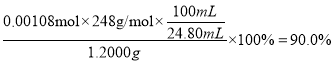 ,
,
答案:90.0%。
(3)设水解的c(CH3COO-)=y
CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
起始量 0.01mol/L 0 0
变化量 x x x
平衡量 0.01-x x x
Kh=![]() ,
,
因为x<<0.01,所以0.01-x≈0.01,
x=1×10-5mol/L,
pH=-lg![]() =9,
=9,
水电离产生的c(H+)=c(OH-)=1×10-5mol/L;
答案为:9;1×10-5mol/L。