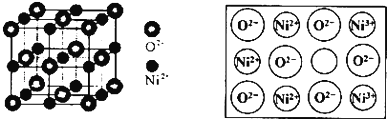
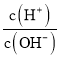题目内容
【题目】下列离子方程式书写正确的是
A.向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值:2Al3++3![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓
C.向Fe(NO3)3溶液中加入过量的HI溶液:2![]() +8H++6I-=3I2+2NO↑+4H2O
+8H++6I-=3I2+2NO↑+4H2O
D.1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl等体积混合:2![]() +5H+=Al(OH)3↓+Al3++H2O
+5H+=Al(OH)3↓+Al3++H2O
【答案】D
【解析】
A.向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值,明矾组成为KAl(SO4)2·12H2O,假设明矾的物质的量为1mol,则n(Al3+)=1mol,n(SO42-)=2mol,滴加Ba(OH)2使Al3+沉淀完全,则产生1molAl(OH)3和1.5molBaSO4沉淀,沉淀的总质量为m1=78g/mol×1mol+233g/mol×1.5mol=427.5g;滴加Ba(OH)2使SO42-沉淀完全,根据量的关系,Al3+全转化为AlO2-,沉淀只有2molBaSO4,沉淀的总质量m2=233g/mol×2mol=466g,m2>m1,其离子方程式为:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故A错误;
B.将少量氯化铁溶液滴入硫化钠溶液中,由于铁离子的氧化性和硫离子的还原性,二者会发生氧化还原反应,生成Fe2+和S,由于S2-过量,则Fe2+与S2-结合成FeS沉淀,离子方程式为:2Fe3++3S2-=2FeS↓+S↓,故B错误;
C.Fe(NO3)3溶液中加入过量的HI溶液,铁离子和硝酸根离子都参与氧化还原反应,正确的离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故C错误;
D.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠的物质的量为1mol,HCl的物质的量为2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO2-+5H+═Al3++Al(OH)3↓+H2O,故D正确;
答案为D。

 口算题天天练系列答案
口算题天天练系列答案