题目内容
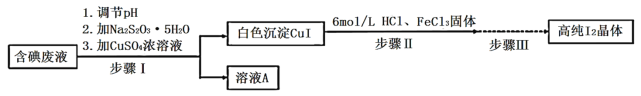
【题目】碘可利用的资源有限,因此碘的工业回收有重要意义。如图是某研究小组设计的从实验室含碘废液(主要含有![]() 、
、![]() 和淀粉等)中回收获得高纯碘晶体的流程。
和淀粉等)中回收获得高纯碘晶体的流程。
已知:![]() ,
,![]() ,实验条件下
,实验条件下![]() 不与
不与![]() 发生氧化还原反应。回答下列问题:
发生氧化还原反应。回答下列问题:
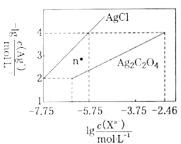
(1)步骤I中,在装有含碘废液的烧杯中,先加入![]() 固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
(2)下列有关步骤I的说法正确的是_________________。
A.实验中应调节![]() 为强酸性环境
为强酸性环境
B.![]() 溶液不能先于
溶液不能先于![]() 晶体加入,是为了防止生成的碘挥发而损失
晶体加入,是为了防止生成的碘挥发而损失
C.加入硫代硫酸钠的量应控制至含碘废液的蓝色刚好褪去
D.溶液![]() 中含硫元素的离子可能有
中含硫元素的离子可能有![]() 、
、![]() 、
、![]() 等
等
(3)步骤Ⅱ为反应生成碘并蒸馏出碘的过程,示意图如图所示:
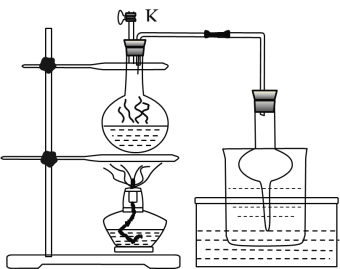
①写出步骤Ⅱ的离子方程式________。
②步骤Ⅱ,检查装置气密性(此时![]() 关闭),在圆底烧瓶中加入
关闭),在圆底烧瓶中加入![]() 和
和![]() 固体及适量
固体及适量![]() ,其后续的操作顺序是________。(选择合理操作,并排序)
,其后续的操作顺序是________。(选择合理操作,并排序)
a.打开![]() b.关闭
b.关闭![]() c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
③实验后期,发现玻璃管中少量碘晶体凝结,其处理的简易操作方法________;
(4)步骤Ⅲ中,主要涉及的操作依次是抽滤、洗涤、干燥和________。其中,抽滤、洗涤沉淀后的滤纸不能丢弃,应保留到后续操作中,其原因是________。
【答案】氧化剂,将溶液中碘元素富集到沉淀中 ![]()
![]()
![]() 用酒精灯加热玻璃管碘晶体凝结处,使碘升华进入烧杯水中 升华 滤纸上有残留碘,可以通过后续干燥、升华回收,提高产率
用酒精灯加热玻璃管碘晶体凝结处,使碘升华进入烧杯水中 升华 滤纸上有残留碘,可以通过后续干燥、升华回收,提高产率
【解析】
实验步骤是:I2与![]() 反应生成I-,生成的I-与自身含有的I-与Cu2+反应生成CuI沉淀;所生成的CuI在酸性条件下和FeCl3反应生成I2,再通过蒸馏得到高纯I2,据此解答。
反应生成I-,生成的I-与自身含有的I-与Cu2+反应生成CuI沉淀;所生成的CuI在酸性条件下和FeCl3反应生成I2,再通过蒸馏得到高纯I2,据此解答。
(1).步骤I中,在装有含碘废液的烧杯中,先加入![]() 固体,发生反应
固体,发生反应![]() ,在搅拌下溶解后,再慢慢加入硫酸铜溶液,发生反应:
,在搅拌下溶解后,再慢慢加入硫酸铜溶液,发生反应:![]() ,故硫酸铜的作用是:氧化剂,将溶液中碘元素富集到沉淀中,故答案为:氧化剂,将溶液中碘元素富集到沉淀中;
,故硫酸铜的作用是:氧化剂,将溶液中碘元素富集到沉淀中,故答案为:氧化剂,将溶液中碘元素富集到沉淀中;
(2)A.在强酸性环境中硫代硫酸钠会发生歧化反应,A不正确;
B.如果先加入![]() 溶液,则会与I-反应生成I2,会有一部分I2挥发,降低利用率,而先加入
溶液,则会与I-反应生成I2,会有一部分I2挥发,降低利用率,而先加入![]() 晶体使I2转变为I-,所以
晶体使I2转变为I-,所以![]() 晶体的作用是固定碘,B正确;
晶体的作用是固定碘,B正确;
C. 加入硫代硫酸钠的量应过量,因为生成的I-与Cu2+反应后还会生成I2,加入过量的硫代硫酸钠能够提高利用率,C不正确;
D.根据反应方程式可知:溶液![]() 中含硫元素的离子可能有
中含硫元素的离子可能有![]() 、
、![]() 、
、![]() ,D正确;
,D正确;
故选:BD;
(3).①步骤Ⅱ的反应式生成的CuI在酸性条件下和FeCl3反应生成I2,故答案为:![]() ;
;
②步骤Ⅱ,检查装置气密性(此时![]() 关闭),在圆底烧瓶中加入
关闭),在圆底烧瓶中加入![]() 和
和![]() 固体及适量
固体及适量![]() ,反应需要加热,所以接下来发生反应生成I2,I2在加热条件下升华,从圆底烧瓶内进入右侧烧杯中凝华成固体,当生成的I2完全升华后停止加热,打开开关K使内外压强一致,防止倒吸,故答案为:
,反应需要加热,所以接下来发生反应生成I2,I2在加热条件下升华,从圆底烧瓶内进入右侧烧杯中凝华成固体,当生成的I2完全升华后停止加热,打开开关K使内外压强一致,防止倒吸,故答案为:![]() ;
;
③因为I2单质易升华,故处理的操作方法是:酒精灯加热玻璃管碘晶体凝结处,使碘升华进入烧杯水中,故答案为:酒精灯加热玻璃管碘晶体凝结处,使碘升华进入烧杯水中;
(4).提纯碘单质的最好方法为升华,在干燥过程后会有一部分碘单质附着在滤纸上,故答案为:升华;滤纸上有残留碘,可以通过后续干燥、升华回收,提高产率。

【题目】100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
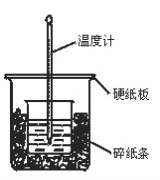
(1)从实验装置图看,尚缺少的一种玻璃仪器是________。
(2)烧杯间填充碎纸条的作用是_________。
(3)按如图装置进行实验,测得中和热的数值_______(填“偏大”“偏小”或“无影响”)其原因是_____。
(4)若实验中改用80 mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_____(填“相等、“不相等”)。
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.5 |
依据该学生测得的实验数据进行计算,中和热ΔH=______(结果保留一位小数)。
(6)能否用稀Ba(OH)2溶液和稀硫酸代替氢氧化钠溶液和盐酸反应测定中和热_______(填“能”或“否”)。
【题目】从能量的变化和反应的快慢等角度研究反应:![]() .
.
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________.
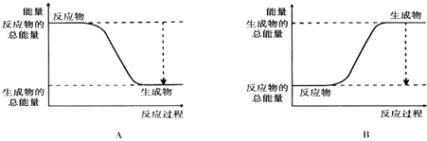
(3)从断键和成键的角度分析上述反应中能量的变化.
化学键 |
|
|
|
键能 |
|
|
|
请填写下表:
化学键 | 填“吸收”或“放出”能量 | 能量变化 | |
拆开化学键 |
| ①________ | ④________ |
| |||
形成化学键 |
| ②________ | ⑤________ |
总能量变化 | ③________ | ⑥________ | |
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
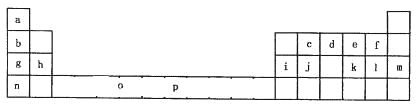
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;