题目内容
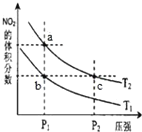
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、![]() 溶液,所得沉淀溶解平衡图像如图所示(不考虑
溶液,所得沉淀溶解平衡图像如图所示(不考虑![]() 的水解)。下列叙述不正确的是( )
的水解)。下列叙述不正确的是( )
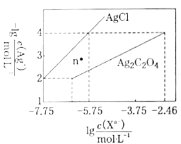
A.n点表示![]() 的不饱和溶液
的不饱和溶液
B.![]() 的值等于10-9.75
的值等于10-9.75
C.![]() 的平衡常数为109.04
的平衡常数为109.04
D.向![]() 的混合液中滴入AgNO3溶液时,先生成
的混合液中滴入AgNO3溶液时,先生成![]() 沉淀
沉淀
【答案】D
【解析】
A.横坐标为lg![]() ,所以横坐标越大表示c(Xn-)越大,纵坐标为-lg
,所以横坐标越大表示c(Xn-)越大,纵坐标为-lg![]() ,则纵坐标越大,c(Ag+)越小,曲线上的点表示沉淀溶解平衡点,n点处c(Ag+)小于相同c(C2O
,则纵坐标越大,c(Ag+)越小,曲线上的点表示沉淀溶解平衡点,n点处c(Ag+)小于相同c(C2O![]() )时对应的平衡点的c(Ag+),所以n点处c(Ag+)·c(C2O
)时对应的平衡点的c(Ag+),所以n点处c(Ag+)·c(C2O![]() )<Ksp[Ag2C2O4],即n点表示Ag2C2O4的不饱和溶液;
)<Ksp[Ag2C2O4],即n点表示Ag2C2O4的不饱和溶液;
B.曲线上的点表示沉淀溶解平衡点,取点(-7.75,2)进行计算,该点溶液中c(Ag+)=10-2mol/L,c(Clˉ)=10-7.75 mol/L,![]() = c(Ag+)·c(Clˉ)=10-2×10-7.75=10-9.75,故B正确;
= c(Ag+)·c(Clˉ)=10-2×10-7.75=10-9.75,故B正确;
C.取点(-2.46,4)计算Ksp[Ag2C2O4]=10-10.46,![]() 的平衡常数K=
的平衡常数K=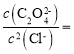
 =
=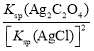 =
=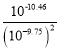 =109.04,故C正确;
=109.04,故C正确;
D.据图可知当![]() 时,生成AgCl沉淀所需的银离子浓度更小,所以滴入硝酸银溶液时,AgCl先沉淀,故D错误;
时,生成AgCl沉淀所需的银离子浓度更小,所以滴入硝酸银溶液时,AgCl先沉淀,故D错误;
故答案为D。

【题目】甲酸![]() 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
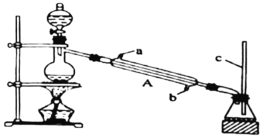
Ⅰ.甲酸能与醇发生酯化反应
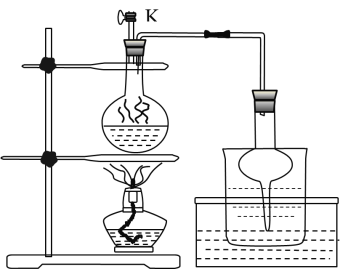
该兴趣小组用如上图所示装置进行甲酸![]() 与甲醇
与甲醇![]() 的酯化反应实验:
的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度 | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是__________,长玻璃管c的作用是__________、__________
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为____________________。
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下,![]() 能与
能与![]() 固体发生反应:
固体发生反应:![]() 。
。
(1)如图所示是以甲酸钠![]() 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:
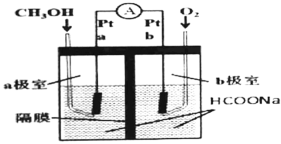
则a极电极反应式为_______________。
(2)测定产物中甲酸钠![]() 的纯度:
的纯度:![]() 与足量
与足量![]() 充分反应后,消耗标况下
充分反应后,消耗标况下![]() ,所得固体物质为
,所得固体物质为![]() ,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
(3)甲酸钠溶液呈弱碱性的原因:__________________(用离子方程式表示)