题目内容
【题目】从能量的变化和反应的快慢等角度研究反应:![]() .
.
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________.
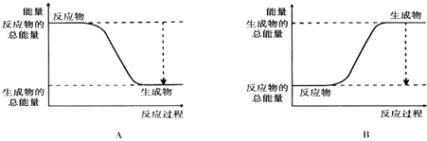
(3)从断键和成键的角度分析上述反应中能量的变化.
化学键 |
|
|
|
键能 |
|
|
|
请填写下表:
化学键 | 填“吸收”或“放出”能量 | 能量变化 | |
拆开化学键 |
| ①________ | ④________ |
| |||
形成化学键 |
| ②________ | ⑤________ |
总能量变化 | ③________ | ⑥________ | |
【答案】ABC A 吸收热量 放出热量 放出热量 1368 1852 484
【解析】
(1)增大反应物浓度、使用催化剂、升高温度等均可加快反应速率;
(2)放热反应中反应物的总能量大于生成物的总能量;
(3)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和。
(1)A.使用催化剂,加快反应速率,故A正确;
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B正确
C.适当提高反应的温度,反应速率加快,故C正确;
D.适当降低反应的温度,反应速率减慢,故D错误;
故答案为ABC;
(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,故答案为A;
(3)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,△H=反应物中键能之和-生成物中键能之和=1368-1852=-484<0,该反应为放热反应;故答案为:
化学键 | 填“吸收热量” | 能量变化 | |
拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
1molO2中的化学键 | |||
形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
总能量变化 | ③放出热量 | ⑥484 | |
。