题目内容
【题目】聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。

(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________。
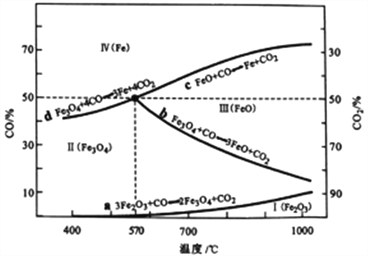
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________。
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________。

【答案】 Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH= 19.4kJ·mol-1 放热反应 1 浪费能量,且FeO易被还原成Fe(或其他合理答案) Fe2+易被空气中的O2氧化咸Fe3+(或其他合理答案) 1.6 4SO42-+ 4Fe2++O2+2H2O=4Fe(OH)SO4↓ 温度升高,反应速率增大;温度过高,NO气体逸出,转化率下降(或其他合理答案)
【解析】(1)Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1、C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1、C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1根据盖斯定律ΔH1-ΔH3=ΔH= 191.9kJ·mol-1-172.5kJ·mol-1,Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH= 19.4kJ·mol-1 ;(2)a随温度的升高,CO%增大,平衡逆向移动,a属于放热反应;570℃时,d反应的平衡常数K=c4(CO2)/c4(CO)==054/0.54= 1。(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是:浪费能量,且FeO易被还原成Fe(或其他合理答案);(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是; Fe2+易被空气中的O2氧化咸Fe3+(或其他合理答案);(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,全氧化时c(Fe3+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,c3(OH-)=Ksp[Fe(OH)3]/c(Fe3+)=1.0×10-39/10-1.8=10-37.2,c(OH-)=10-12.4mol·L-1,c(H+)=10-1.6mol·L-1,应调节浸出液的pH≤1.6;(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,反应的离子方程式为 4SO42-+ 4Fe2++O2+2H2O=4Fe(OH)SO4↓ ;从图可知,70℃为最佳温度,Fe2+转化率随温度的升高先上升后下降的原因是: 温度升高,反应速率增大;温度过高,NO气体逸出,转化率下降(或其他合理答案)。

【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。
