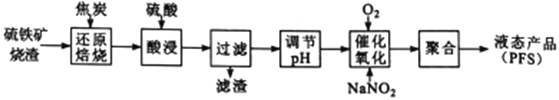
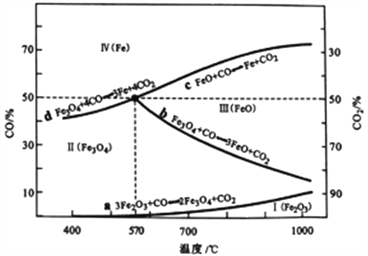
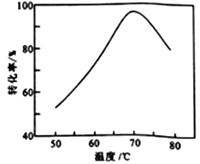
题目内容
【题目】下表中元素的原子间相互作用可以形成离子键的是( )
元素 | a | b | c | d | e | f | g |
原子的M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A.b和gB.a和cC.d和gD.e和f
【答案】A
【解析】
活泼金属与活泼非金属相互作用时一般形成离子键,a~g依次为Na、Mg、Al、Si、P、S、Cl七种元素,Mg和Cl相互作用形成离子键,故A符合题意。
综上所述,答案为A。

练习册系列答案
相关题目
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
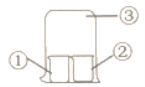
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D