题目内容
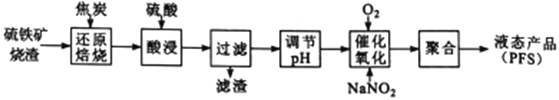
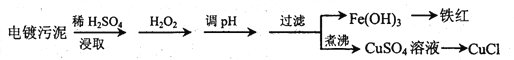
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。
【答案】 将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离 3.2-4.4 B 除净溶液中的H2O2,避免影响下一步CuCl的生成 2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4 取最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,未洗涤干净,反之洗涤干净 99.50%
【解析】(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物,双氧水有强氧化性,能氧化还原性的物质,Fe2+具有还原性,酸浸后加入H2O2,Fe2+能被双氧水氧化为高价离子,便于调整pH值与Cu2+分离,调pH步骤中加入的试剂最好是加入某种物质除去溶液中的酸且不引进新的杂质,所以要加入氧化铜或氢氧化铜或碳酸铜,当溶液的pH值4.4时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,从而使三价铁离子和铜离子分离,因此调pH的最适宜范围为3.2~4.4;(2)根据以上分析可知调pH过程中加入的试剂最好是氧化铜,答案选B;(3)过氧化氢加热分解为水和氧气,将溶液中过量的H2O2除去可避免影响下一步CuCl的生成;因为CuSO4中+2价的铜能把Na2SO3中+4价的硫氧化成+6价的硫,向CuSO4溶液中加入一定量的NaCl、Na2SO3时生成白色的CuCl沉淀,反应的化学方程式为2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4;(4)过滤后的沉淀表面通常附着有硫酸根离子,因此确定沉淀洗涤干净的操作及现象是取最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,未洗涤干净,反之洗涤干净;(4)设样品中CuCl的质量为x,有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则由化学反应方程式可知:
CuCl~~~Fe2+~~~Ce4+
1 1
n(CuCl) 25.00×10-3L×0.1000 mol/L
所以n(CuCl)=2.50×10-3mol,则该样品CuCl的质量为2.50×10-3mol×99.5g/mol=0.24875g,所以0.2500g该样品CuCl的质量分数为0.24875g/0.2500g×100%=99.50%。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案