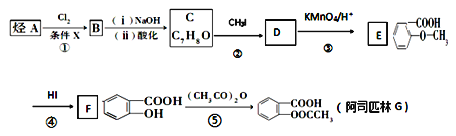
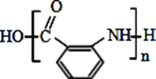
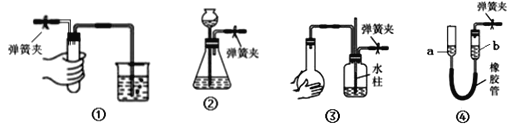
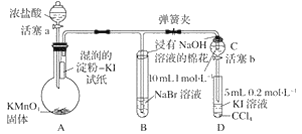
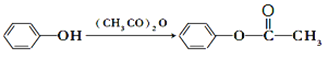题目内容
【题目】对下列实验过程的评价,正确的是( )
A. 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO![]()
C. 用萃取的方法分离汽油和煤油
D. 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
【答案】D
【解析】A.无色气体可能为二氧化硫,则固体可能为碳酸盐、碳酸氢盐、亚硫酸盐、亚硫酸氢盐等,故A错误;B.白色沉淀可能为AgCl,则原溶液可能含银离子或硫酸根离子,但二者不同时存在,故B错误;C.汽油和煤油互溶,但沸点不同,应利用蒸馏分离,故C错误;D.先加硝酸排除干扰离子,再加硝酸银生成的白色沉淀为AgCl,则证明含Cl-,故D正确;故答案为D。

练习册系列答案
相关题目