��Ŀ����
����Ŀ������0.1000 mol��L��1KMnO4������Һ�ζ�δ֪Ũ�ȵ���ɫH2C2O4��Һ����Ӧ���ӷ���ʽ�ǣ�2MnO4����5H2C2O4��6H+ = 2Mn2+��10CO2����8H2O
���������⣺
��1���õζ�ʵ������IJ���������______________��������ĸ��
A����ʽ�ζ���B����ʽ�ζ��� C����Ͳ D����ƿ E������̨F���ζ��ܼ�G���ձ�H����ֽ I��©��
��2������________(��ᡱ�)ʽ�ζ���ʢ�Ÿ��������Һ���Է���ԭ��___________________________________________��
��3���ζ��յ������Ϊ___________________________________��
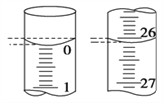
��4�����ζ���ʼ�ͽ���ʱ���ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ________mL���յ����Ϊ________mL��
��5��ijѧ������3��ʵ��ֱ��¼�й��������±���
�ζ� ���� | ����H2C2O4��Һ�����/mL | 0.1000 mol/L KMnO4�������mL�� | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.22 | 26.31 | 26.09 |
�����ϱ�������ʽ�����H2C2O4��Һ�����ʵ���Ũ��Ϊ_______________��
��6�����в����п���ʹ�ⶨ���ƫ�͵���___________(����ĸ)��
A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ
B���ζ�ǰʢ�Ų�����Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ���������
D����ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
���𰸡� ADG �� ������ؾ���ǿ�������ܸ�ʴ�ܣ�����������Һ�ܰ��������� �������һ�θ��������Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ��ָ�ԭɫ 0.00 26.10 0.2610 mol/L CD
����������1����������ԭ�ζ����貣�������У�ʢװ����KMnO4��Һ��ȡ�ô���ҺH2C2O4��Һ����ʽ�ζ��ܡ�ʢװ����ҺH2C2O4��Һ����ƿ������Һ�漰������ʱʢ����Һ�õ��ձ�������ӦѡADG��
��2����Ϊ������ؾ���ǿ�������ܸ�ʴ�ܣ����Բ��ü�ʽ�ζ���ʢ�Ÿ��������Һ��
��3��MnO4-Ϊ��ɫ��K+Ϊ��ɫ�����������һ�θ��������Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ��ָ�ԭɫ����˵���ﵽ�ζ��յ㡣
��4����ͼ��ʾ������ʱ����Ӧ�밼Һ����ʹ����У�����ʼ����Ϊ0.00mL���յ����Ϊ26.10mL��
��5����2������������������ϴ������ݵ���Ч�ԣ�Ӧ��ȥ��2�����ݣ����ĵ�V(KMnO4)=(26.11+26.09)mL��2=26.10mL���ɷ���ʽ2MnO4����5H2C2O4��6H+ = 2Mn2+��10CO2����8H2O�ɵ���n(H2C2O4)= ![]() n(MnO4-)������c(H2C2O4)��0.025L=
n(MnO4-)������c(H2C2O4)��0.025L=![]() ��0.1000molL-1��0.02610L�����c(H2C2O4)=0.2610molL-1��
��0.1000molL-1��0.02610L�����c(H2C2O4)=0.2610molL-1��
��6������c(��)= 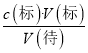 ������������A���ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ�����Һ��Ũ��ƫС�����V(��)ƫ��c(��)ƫ��A����B��ζ�ǰʢ��H2C2O4��Һ����ƿ������ˮϴ����û�и����V(��)û��Ӱ�죬c(��)���䣬��B����C���ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��������ݣ����V(��)ƫС��c(��)ƫС����C��ȷ��D���ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��������V(��)ƫС��c(��)ƫС����D��ȷ��
������������A���ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ�����Һ��Ũ��ƫС�����V(��)ƫ��c(��)ƫ��A����B��ζ�ǰʢ��H2C2O4��Һ����ƿ������ˮϴ����û�и����V(��)û��Ӱ�죬c(��)���䣬��B����C���ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��������ݣ����V(��)ƫС��c(��)ƫС����C��ȷ��D���ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��������V(��)ƫС��c(��)ƫС����D��ȷ��

����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ_____ ������ȣ����ȣ���ȷ��������Ӧ��
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol��������ˮ�����뺬��0.2mol�������Һ��Ӧ����QkJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ_____��
��3������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��

��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2�����������=����������
����������һ���������¶ȣ������IJ��ʻ�__�����������С����С�������䡱���䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL��1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6