题目内容
【题目】关于下列各图的叙述正确的是

A. 甲中△H1=-(△H2+△H3)
B. 乙表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C. 丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D. 丁表示常温下,稀释HA、HB两种酸的稀溶液时,蒋液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH
【答案】A
【解析】试题分析:A、根据盖斯定律,甲中△H2=-(△H2+△H3),故A正确;B、乙表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,横坐标向右表示浓度增大,纵坐标向上表示物质消耗速率快,如果达到平衡状态,则二者消耗速率之比等于化学计量数之比即应该等于
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,横坐标向右表示浓度增大,纵坐标向上表示物质消耗速率快,如果达到平衡状态,则二者消耗速率之比等于化学计量数之比即应该等于![]() ,故B错误;C、将A、B饱和溶液分别由T1℃升温至T2℃时两溶液中溶质和溶剂的量都不会改变,而二者T1℃溶解度相同,即浓度相同,所以T2℃时溶质的质量分数相等,故C错误;D、常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化可知酸性HA大于HB,NaB溶液中B水解程度大,产生OH-浓度大,pH大,故D错误,故选A。
,故B错误;C、将A、B饱和溶液分别由T1℃升温至T2℃时两溶液中溶质和溶剂的量都不会改变,而二者T1℃溶解度相同,即浓度相同,所以T2℃时溶质的质量分数相等,故C错误;D、常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化可知酸性HA大于HB,NaB溶液中B水解程度大,产生OH-浓度大,pH大,故D错误,故选A。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
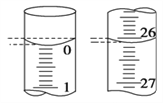
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数

