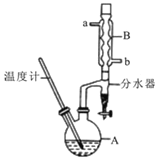
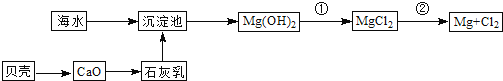
��Ŀ����
����Ŀ����������[Ce(OH)4]��һ����Ҫ��ϡ��������Է�̼���(��Ҫ��CeFCO3)Ϊԭ���Ʊ�Ce(OH)4��һ�ֹ����������£�
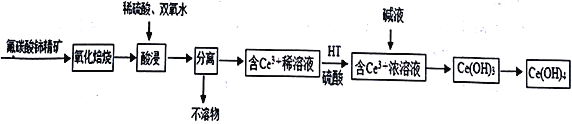
��֪����������Һ��Ce4+��ǿ�����ԡ��ش�����������
��1�� ������������ǰ�轫��ʯ�����ϸ��������Ŀ����_________________________��������CeFCO3 ��Ce �Ļ��ϼ�Ϊ________________________��
��2�������������ɵ��滯����Ϊ��������(CeO2)���������ʱ������Ӧ�����ӷ���ʽΪ__________________________________�����ʱ�����¶ȹ��ߵ�ԭ����____________________��
��3����֪�л���HT �ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2 Ce3+ (ˮ��) +6HT (�л���)![]() 2CeT3 (�л���) +6H+ (ˮ��)
2CeT3 (�л���) +6H+ (ˮ��)
��ƽ���ƶ��ǶȽ����� ��CeT3(�л���) ����H2SO4��ýϴ��ĺ�Ce3+��ˮ��Һ��ԭ����____________________��
��4��Ce(OH)3��¶�ڿ�����ʱ�����ɫ�����ձ�ɻ�ɫ��Ce(OH)4���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________��
��5����֪298 K ʱ��Ksp[Ce(OH)3]=1��10-20��Ϊ��ʹ��Һ��Ce3+������ȫ�������pHΪ______���ϡ�
���𰸡� �������������ĽӴ����������Ӧ���ʣ����ԭ�ϵ������� +3 2CeO2+H2O2+6H+===2Ce3+ +O2��+4H2O H2O2�����ֽ� ���Һ�м��� H2SO4 ʹ c(H+)����ƽ�����γ� Ce3+ˮ��Һ�����ƶ� 4Ce(OH)3 +O2+2H2O===4Ce(OH)4 9
�����������⿼�黯ѧ�������̣���1����ʯ����ɿ���������Ӵ�������ӿ췴Ӧ���ʣ����ԭ�ϵ������ʣ�CeFCO3��CO3�ԣ�2�ۣ�F�ԣ�1�ۣ����廯�ϼ۴�����Ϊ0����Ce�ԣ�3�ۣ���2����������Һ��Ce4����ǿ�����ԣ�������������ǿ����������ʱ�����ֻ�ԭ�ԣ���������������������ʱ�����ӷ���ʽΪ2CeO2��H2O2��6H��=2Ce3����O2����4H2O����Ϊ�������ⲻ�ȶ��������ֽ⣬������ʱ�¶Ȳ��ܹ��ߣ���ֹH2O2���ȷֽ⣻��3��������ȡ�Ĺ��̣��������ᣬ����c(H��)��ʹƽ�����淴Ӧ������У���4��������ϢCe�Ļ��ϼ��ɣ�3�ۡ���4�ۣ����ϼ����ߣ�Ӧ������������������Ӧ����ʽΪ��4Ce(OH)3 +O2+2H2O=4Ce(OH)4 ����5��������Ũ��С�ڻ����10��5mol��L��1��������ȫ�������ܶȻ��ı���ʽc(OH��)= 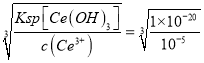 =10��5mol/l��c(H��)=Kw/c(OH��)=10��9mol��L��1����pH=9��
=10��5mol/l��c(H��)=Kw/c(OH��)=10��9mol��L��1����pH=9��

 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�����Ŀ������0.1000 mol��L��1KMnO4������Һ�ζ�δ֪Ũ�ȵ���ɫH2C2O4��Һ����Ӧ���ӷ���ʽ�ǣ�2MnO4����5H2C2O4��6H+ = 2Mn2+��10CO2����8H2O
���������⣺
��1���õζ�ʵ������IJ���������______________��������ĸ��
A����ʽ�ζ���B����ʽ�ζ��� C����Ͳ D����ƿ E������̨F���ζ��ܼ�G���ձ�H����ֽ I��©��
��2������________(��ᡱ�)ʽ�ζ���ʢ�Ÿ��������Һ���Է���ԭ��___________________________________________��
��3���ζ��յ������Ϊ___________________________________��
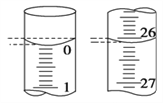
��4�����ζ���ʼ�ͽ���ʱ���ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ________mL���յ����Ϊ________mL��
��5��ijѧ������3��ʵ��ֱ��¼�й��������±���
�ζ� ���� | ����H2C2O4��Һ�����/mL | 0.1000 mol/L KMnO4�������mL�� | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.22 | 26.31 | 26.09 |
�����ϱ�������ʽ�����H2C2O4��Һ�����ʵ���Ũ��Ϊ_______________��
��6�����в����п���ʹ�ⶨ���ƫ�͵���___________(����ĸ)��
A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ
B���ζ�ǰʢ�Ų�����Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ���������
D����ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���