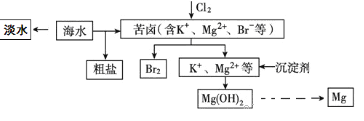
题目内容
【题目】(1)将氨气通入水中,发生化学反应的方程式有_______;下列有关分析中正确的是_______;
A.常温时氨气易溶于水
B.通常情况下氨气在水中的溶解度不大
C.溶于水的氨气分子有少量发生电离
D.氨水中的NH3H2O可电离出少量OH-
E.氨本身具有弱碱性
F.在饱和氨水中含量最多的溶质是NH3H2O
(2)氨水有许多用途,请任写一个用氨水制取不溶性碱的方程式_______。
【答案】NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-ADF3NH3H2O+AlCl3=Al(OH)3↓+3NH4Cl
NH4++OH-ADF3NH3H2O+AlCl3=Al(OH)3↓+3NH4Cl
【解析】
(1)氨气和水反应生成一水合氨,一水合氨是弱碱存在电离平衡,反应的化学方程式为NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-;氨气极易溶于水,大部分和水反应生成一水合氨,氨气本身不能发生电离属于非电解质,生成的一水合氨存在电离平衡电离出氢氧根离子,溶液显碱性,氨气本身不显碱性,氨水溶液中含量最多的溶质主要是一水合氨,ADF正确;
NH4++OH-;氨气极易溶于水,大部分和水反应生成一水合氨,氨气本身不能发生电离属于非电解质,生成的一水合氨存在电离平衡电离出氢氧根离子,溶液显碱性,氨气本身不显碱性,氨水溶液中含量最多的溶质主要是一水合氨,ADF正确;
(2)氨水和氯化铝溶液发生反应生成氢氧化铝沉淀和氯化铵,反应的化学方程式为3NH3H2O+AlCl3=Al(OH)3↓+3NH4Cl。

 阅读快车系列答案
阅读快车系列答案【题目】乙酰苯胺是较早使用的一种解热镇痛药,可由苯胺和乙酸反应制备:
![]()
已知:① 苯胺易被氧化;
② 乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4℃ | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:

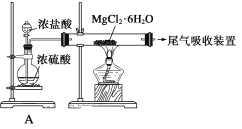
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照右图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________ 、起着沸石的作用。
(2)步骤2中控制温度计示数约105 ℃,接引管流出的主要物质是________________,若温度过高,会导致________________。刺形分馏柱中,由下到上,温度逐渐________________(填“升高”、“降低”或“不变”)。
(3)步骤3中抽滤装置所包含的仪器除减压系统外,还有吸滤瓶、________________(填仪器名称)。
(4)步骤3得到的粗产品可采取重结晶的方法进一步提纯,操作步骤是________________。
【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
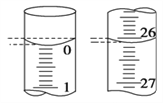
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数