题目内容
【题目】为探究 Fe3+和 Cu2+对 H2O2 分解反应的催化效果,甲、乙两组同学分别设计了如图1、图 2所示的实验。下列叙述中不正确的是( )
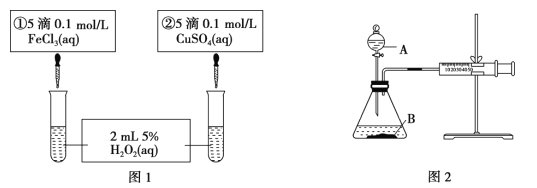
A. 图 1 实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图 1 所示实验速率为①>②,则一定能说明 Fe3+比 Cu2+对 H2O2 分解催化效果好
C. 用图 2 装置比较反应速率,可测定相同时间相同状况产生气体体积的多少进行比较
D. 图 2 中将注射器活塞拉出一定距离,一段时间后松开活塞,能返回原处,则不漏气
【答案】B
【解析】A.过氧化氢分解生成水和氧气,所以可以通过观察产生气泡的快慢来比较反应速率的大小,故正确;B. 若图 1 所示实验速率为①>②,但加入的阳离子不同,阴离子也不同,不能由此确定铁离子比铜离子的催化效果好,故错误;C.相同时间内气体体积的多少可以说明反应的快慢,故正确;D. 图 2 中将注射器活塞拉出一定距离,一段时间后松开活塞,能返回原处,则说明装置不漏气,故正确。故选B。

【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
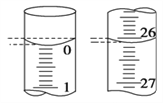
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
