题目内容
【题目】[化学﹣﹣选修物质结构与性质]下表为元素周期表的一部分.请回答下列问题: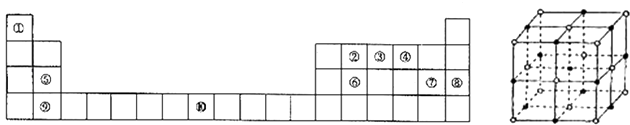
(1)上述元素中,属于s区的是(填元素符号).
(2)写出元素⑩的基态原子的电子排布式 .
(3)元素第一电离能为⑤⑨(填“大于”或“小于”).
(4)元素③气态氢化物的中心原子有对弧对电子,其VSEPR模型为;中心原子的杂化类型为;该分子为分子(填“极性”或“非极性”).向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为 .
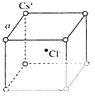
(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为 . 若设该晶胞的棱长为a cm,阿伏伽德罗常数的值为NA , 则该钠盐的密度为 .
【答案】
(1)H、Mg、Ca
(2)1s22s22p63s23p63d64s2
(3)大于
(4)1,正四面体,sp3,极性,先产生蓝色沉淀,后溶解得深蓝色溶液
(5)12,![]()
【解析】(1)由图可知①⑤⑨处于s区,由①位于第一周期第ⅠA族,是氢元素;⑤位于第三周期第ⅡA族,是镁元素;
⑨位于第四周期第ⅡA族,是钙元素.
所以答案是:H、Mg、Ca.
(2)元素⑩为26号元素,是Fe,其基态原子的电子排布式1s22s22p63s23p63d64s2.
所以答案是:1s22s22p63s23p63d64s2.
(3)元素⑤与⑨处于同一主族,元素⑨核电荷数大,金属性更强,第一电离能小.
所以答案是:大于.
(4)元素③为N元素,其气态氢化物为NH3,中心原子有1对孤对电子,N原子价层电子对为4,其VSEPR模型为正四面体;
N原子的杂化轨道数为4,所以N原子采取sp3杂化;
NH3空间结构不对称,N元素化合价绝对值大于3,故NH3是极性分子;向硫酸铜溶液中逐滴加入氨水,先生成氢氧化铜蓝色沉淀,滴加过量氨水,氢氧化铜与NH3生成深蓝色四氨合铜络离子,沉淀溶解.
所以答案是:1;四面体;sp3;极性;先产生蓝色沉淀,后溶解得深蓝色溶液.
(5)元素⑦为氯元素,其钠盐为NaCl,在氯化钠晶胞中若以黑色球为钠离子,白色球为氯离子,以中心的黑色球钠离子分析,Na+周围与之距离最近的Na+处于对角线上,故有12个.
氯化钠晶胞中钠离子数为1+12× ![]() =4,氯离子数为8×
=4,氯离子数为8× ![]() +6×
+6× ![]() =4,所以含有的NaCl分子个数为4个,氯化钠晶胞质量为
=4,所以含有的NaCl分子个数为4个,氯化钠晶胞质量为 ![]() ,晶胞体积为a3cm3,所以氯化钠的密度为ρ=
,晶胞体积为a3cm3,所以氯化钠的密度为ρ= 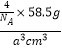 =
= ![]() .
.
所以答案是:12; ![]() .
.

【题目】如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,金属性最强的元素是 , 最活泼的非金属元素是;
(2)化学性质最不活泼的元素是 , 其原子的原子结构示意图为;
(3)元素的最高价氧化物对应的水化物中酸性最强的是 , 碱性最强的是 , 呈两性的氢氧化物是;
(4)在③~⑦元素中,原子半径最大的是 , 原子半径最小的是;
(5)在⑦与⑩的单质中,化学性质较活泼的是 , 可用什么化学反应说明该事实(写出反应的化学方程式): .
【题目】某无色澄清溶液中Cl﹣浓度为0.5molL﹣1 , 还可能含有表中的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3﹣ CO32﹣ SiO32﹣ SO42﹣ OH﹣ |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子有 . 能确定一定不存在的离子是
(2)实验Ⅰ中生成沉淀的离子方程式为 .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(molL﹣1) |
① | |
② | |
③ |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: .