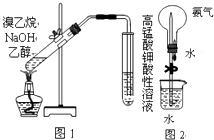
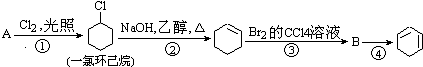
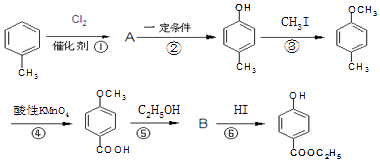
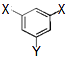��Ŀ����
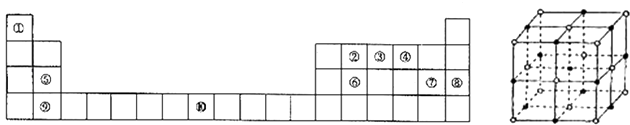
����Ŀ�������Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1������ЩԪ���У���������ǿ��Ԫ���� �� ����õķǽ���Ԫ������
��2����ѧ��������õ�Ԫ���� �� ��ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ��
��3��Ԫ�ص�����������Ӧ��ˮ������������ǿ���� �� ������ǿ���� �� �����Ե�������������
��4���ڢۡ���Ԫ���У�ԭ�Ӱ뾶������ �� ԭ�Ӱ뾶��С������
��5���ڢ����ĵ����У���ѧ���ʽϻ��õ��� �� ����ʲô��ѧ��Ӧ˵������ʵ��д����Ӧ�Ļ�ѧ����ʽ���� ��
���𰸡�
��1��K,F
��2��Ar,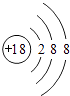
��3��HClO4,KOH,Al��OH��3
��4��Na,Cl
��5��Cl2,2NaBr+Cl2=2NaCl+Br2
���������⣺��Ԫ�������ڱ��е�λ�ÿ�֪����ΪN����ΪF����ΪNa����ΪMg����ΪAl����ΪSi����ΪCl����ΪAr����ΪK����ΪBr��
��1��ͬ����������ҽ����Լ������ǽ�������ǿ��ͬ�������϶��½�������ǿ���ǽ����Լ�����������Ԫ���У���������ǿ��Ԫ����K������õķǽ���Ԫ����F��
���Դ��ǣ�K��F��
��2��ϡ������Kr�Ļ�ѧ��������ã���ԭ�Ӻ�����18�����ӣ����������Ϊ2��8��8����ԭ�ӽṹʾ��ͼΪ��  ��
��
���Դ��ǣ�Ar��  ��
��
��3������Ԫ���г�F��Fû�����ۣ���Cl�ķǽ�������ǿ��������������Ӧ��ˮ�����������ǿ������ΪHClO4��K�Ľ�������ǿ����KOH�ļ�����ǿ��Al��OH��3Ϊ�����������
���Դ��ǣ�HClO4��KOH��Al��OH��3��
��4��ͬ�����������ԭ�Ӱ뾶��С���ڢۡ���Ԫ���У�ԭ�Ӱ뾶������Na��ԭ�Ӱ뾶��С����Cl��
���Դ��ǣ�Na��Cl��
��5��ͬһ������ϵ��·ǽ����Լ��������ʵĻ��������������������Ļ�����ǿ���嵥�ʣ�����ͨ��ˮ��Һ�е��û���Ӧ��֤������Ӧ����ʽΪ��2NaBr+Cl2=2NaCl+Br2��
���Դ��ǣ�Cl2��2NaBr+Cl2=2NaCl+Br2��

 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�����Ŀ���廯����ҽҩ����������������ҩ��ʵ�����á����ط����Ʊ��廯�Ƶ���Ҫ�������£�
�廯�ƵIJ����ܽ����ֵ���£�
�¶� | 0�� | 10�� | 20�� | 40�� | 60�� | 80�� | 100�� |
�ܽ�ȣ�g�� | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
��1��6Ca��OH��2+6Br2 ![]() 5CaBr2+6H2O+Ca��BrO3��2 �� ÿ����1mol Ca��BrO3��2ת�Ƶ��ӵ����ʵ���Ϊ��50��70��ʱ������[CO��NH2��2]�����ɵ�Ca��BrO3��2��ԭΪCaBr2 �� ���ر�����ΪN2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ ��
5CaBr2+6H2O+Ca��BrO3��2 �� ÿ����1mol Ca��BrO3��2ת�Ƶ��ӵ����ʵ���Ϊ��50��70��ʱ������[CO��NH2��2]�����ɵ�Ca��BrO3��2��ԭΪCaBr2 �� ���ر�����ΪN2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����������IJ���������������� ��
��3�������������pH�������� ��
��4������I�����������ˡ���ˮϴ�ӡ����
��5�������������Ʊ����������Ʒ�г�������������������ѡ�����ṩ���Լ�����д�������������Ʒ���Ƿ���SO42����ʵ�鷽���� ��