题目内容
【题目】根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为 . 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据VSEPR模型,PO43﹣的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏伽德罗常数,则氯化铯晶体的密度为g/cm3 . 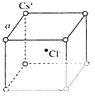
【答案】
(1)31,硒
(2)正四面体,乙醇和水分子之间形成氢键,HClO4分子中非羟基氧多
(3)分子晶体
(4)[Ne]3s2或1s22s22p63s2,第4周期VIB族,d
(5)![]()
【解析】解:(1)最外层电子排布为4s24p1的原子的核电荷数=2+8+18+3=31;某元素原子的外围电子排布是4s24p4,其核内质子数=2+8+18+6=34,为Se元素,
所以答案是:31;硒;
(2)磷酸根离子价层电子对个数为4且不含孤电子对,根据价层电子对互斥理论知磷酸根离子空间构型为正四面体结构;乙醇和水分子之间形成氢键而增大乙醇的溶解性,导致乙醇和水互溶;含氧酸中非羟基O原子个数越多其酸性越强,高氯酸中非羟基氧原子个数大于次氯酸,所以高氯酸酸性大于次氯酸,
所以答案是:正四面体;乙醇与水分子间形成氢键;HClO4分子中非羟基氧多;
(3)氯化铁熔沸点较低,所以为分子晶体,所以答案是:分子晶体;
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,设其最外层电子数是x,则x=
,设其最外层电子数是x,则x= ![]() ×(2+8+x),x=2,根据构造原理书写其基态原子核外电子排布式为:[Ne]3s2或1s22s22p63s2;Cr位于第四周期第VIB族,位于d区,
×(2+8+x),x=2,根据构造原理书写其基态原子核外电子排布式为:[Ne]3s2或1s22s22p63s2;Cr位于第四周期第VIB族,位于d区,
所以答案是:[Ne]3s2或1s22s22p63s2;第4周期VIB族;d;
(5)晶体中2个最近的Cs+核间距为a pm,位于顶点上相邻的Cs+最近,
则晶胞边长为a×10﹣10cm,晶胞体积=(a×10﹣10)3cm3,该晶胞中氯离子个数是1、Cs+个数=8× ![]() =1,
=1,
其密度= ![]() =
=  g/cm3=
g/cm3= ![]() g/cm3,
g/cm3,
所以答案是: ![]() .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案