题目内容
【题目】A,B,C,D都是短周期元素,原子半径D>C>A>B,其中A,B处在同一周期,A,C处在同一主族.C原子核内质子数等于A,B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A , B , C , D .
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是 .
(3)A与B形成的三原子分子的电子式是 , B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 .
【答案】
(1)C;O;Si;Na
(2)H2O>CH4>SiH4
(3)![]() ;
;![]()
(4)2CO2+2Na2O2═2Na2CO3+O2
【解析】解:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ![]() ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,(1)由上面的分析可知,A为C元素,B为O元素,C为Si元素,D为Na元素,故答案为:C;O;Si; Na;(2)四种元素中在常温常压下有液态或气态氢化物的为C、O、Si,它们的非金属性O>C>Si,故氢化物的稳定性为H2O>CH4>SiH4 , 故答案为:H2O>CH4>SiH4;(3)A与B形成的三原子分子为CO2 , 其电子式是
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,(1)由上面的分析可知,A为C元素,B为O元素,C为Si元素,D为Na元素,故答案为:C;O;Si; Na;(2)四种元素中在常温常压下有液态或气态氢化物的为C、O、Si,它们的非金属性O>C>Si,故氢化物的稳定性为H2O>CH4>SiH4 , 故答案为:H2O>CH4>SiH4;(3)A与B形成的三原子分子为CO2 , 其电子式是 ![]() ,B与D形成的原子个数比为1:1的化合物为过氧化钠,它的电子式是
,B与D形成的原子个数比为1:1的化合物为过氧化钠,它的电子式是 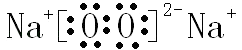 ,故答案为:
,故答案为: ![]() ;
; 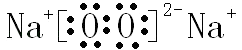 ;(4)A元素某氧化物与D元素某氧化物反应生成单质,应是二氧化碳与过氧化钠反应生成碳酸钠与氧气,反应化学方程式是2CO2+2Na2O2═2Na2CO3+O2 , 故答案为:2CO2+2Na2O2═2Na2CO3+O2 .
;(4)A元素某氧化物与D元素某氧化物反应生成单质,应是二氧化碳与过氧化钠反应生成碳酸钠与氧气,反应化学方程式是2CO2+2Na2O2═2Na2CO3+O2 , 故答案为:2CO2+2Na2O2═2Na2CO3+O2 .
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ![]() ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,据此解答该题.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,据此解答该题.

【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ·mol-1)依次为 578、1817、2745、11575、14830、18376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)X元素位于元素周期表第____周期____族; R是________区的元素。
(2)请写出Q元素基态原子的外围电子排布图____。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是________。(用元素符号表示)
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是________。
(5)含Z元素的焰火显黄色,主要与________有关。
(6)M元素原子的逐级电离能越来越大的原因是________。
(7)与M元素成“对角线规则”关系的某短周期元素T的最髙价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:________;己知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是________。(填“离子化合物”或“共价化合物”)
【题目】烟气中含有 SO2 等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
ⅠCaCO3(s)![]() CO2(g)+CaO (s) △H = + 178.2 kJ/mol
CO2(g)+CaO (s) △H = + 178.2 kJ/mol
ⅡSO2(g)+CaO(s)![]() CaSO3(s) △H = - 402 kJ/mol
CaSO3(s) △H = - 402 kJ/mol
Ⅲ 2CaSO3(s) + O2 (g) + 4H2O(l)![]() 2[CaSO4· 2H2O](s) △H = - 234.2 kJ/mol
2[CaSO4· 2H2O](s) △H = - 234.2 kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式________________________________________________________
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是_______________
a.3个容器中SO2的平衡转化率的大小顺序为:αA > αB > αC
b.当A容器内气体的平均摩尔质量不变时,说明该反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA > tB
d.当 C 容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据上述反应Ⅱ来除硫,将一定量的烟气压缩到一个 20 L的容器中,测得不同温度下,容器内 SO2 的质量(mg)如下表:
时间/min SO2质量/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
T2 | 2100 | 869 | 242 | x | x | x | x |
①在T1温度下,计算20~40min内SO2 的反应速率____________mol/(L· min)。
②若其它条件都相同,则T1______T2(填“>”、 “<” 或 “=”,下同); x _____ 0.06。
③在T2温度下,若平衡后将容器的容积压缩为10 L,则新平衡时SO2的浓度_____原平衡时SO2的浓度(填“>”、 “<” 或 “=”),理由是________________________________。


