题目内容
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
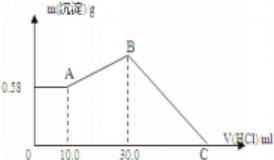
(1)混合物中各物质的物质的量:
NaOH是_______,AlCl3是________,MgCl2是________。
(2)C点所加的盐酸的体积是________mL。
【答案】 0.11 mol 0.02 mol 0.01 mol 110
【解析】(1)向所得悬浊液中逐滴加入1.00mol/L盐酸溶液时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,物质的量是0.58g÷58g/mol=0.01mol,根据Mg原子守恒得n(MgCl2)=0.01mol;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为AlO2-+H++H2O=Al(OH)3↓,根据HCl的体积可判断n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.02mol×3+0.03L×1mol/L=0.11mol;(3)C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.11mol;C点所表示盐酸的体积为:V=0.11mol÷1mol/L=0.11L=110mL。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl | ③ | ⑤Na2CO3 | ⑦CO2 | ⑨NH3 |
(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥的后面.
(2)写出实验室由⑩制备O2的化学方程式: .




