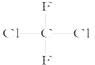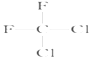题目内容
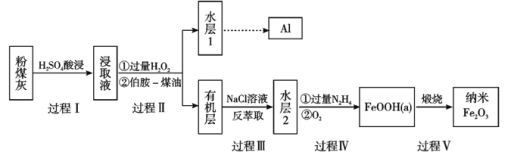
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
已知:
i)伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_____________。
(2)写出过程Ⅱ加入过量H2O2发生的离子方程式_____________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_____________。
(3)从化学平衡角度解释过程Ⅲ利用NaCl溶液进行反萃取的原理_____________。
(4)过程Ⅳ中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_______________。
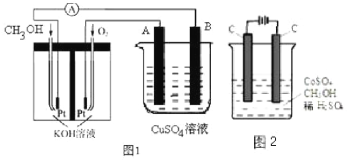
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:
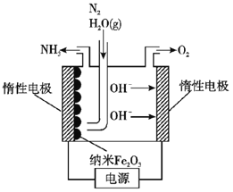
第一步:Fe2O3+3H2O+6e-=2Fe+6OH-;
第二步:2Fe+N2+3H2O=Fe2O3+2NH3。
则该电解池发生总反应的化学方程式为___________________________________,纳米Fe2O3在电解过程中所起的作用是___________________________________。
(6)某特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3),若x平均值为1.3,则磁流体中Fe3+和Fe2+的质量之比为___________。
【答案】SiO2 2Fe2++H2O2+2H+=2Fe3++2H2O 萃取、分液 Fe3++6Cl-![]() [FeCl6]3-,Cl-结合Fe3+,Fe3+浓度减小,促使3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-,Cl-结合Fe3+,Fe3+浓度减小,促使3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+平衡逆向移动,实现反萃取 4:1 2N2+6H2O
Fe(NH2-R)3(OH)SO4+H+平衡逆向移动,实现反萃取 4:1 2N2+6H2O![]() 2NH3+3O2 催化剂 7:3
2NH3+3O2 催化剂 7:3
【解析】
粉煤灰中Al2O3、Fe2O3、Fe3O4与硫酸反应生成可溶性硫酸铝、硫酸铁、硫酸亚铁,SiO2与硫酸不反应,过滤后的滤渣成分是SiO2;滤液中的Fe2+被过氧化氢氧化为Fe3+,伯胺R-NH2能与Fe3+反应生成易溶于煤油的产物,分液后Fe(NH2-R)3(OH)SO4存在煤油中,有机层加入氯化钠溶液反萃取,发生Fe3++6Cl-![]() [FeCl6]3-,[FeCl6]3-中加入过量N2H4生成Fe2+,通入适量氧气氧化为FeOOH,煅烧生成纳米Fe2O3。
[FeCl6]3-,[FeCl6]3-中加入过量N2H4生成Fe2+,通入适量氧气氧化为FeOOH,煅烧生成纳米Fe2O3。
(1)过程I对煤粉灰进行酸浸过滤后,SiO2与硫酸不反应,过滤后的滤渣成分是SiO2。
(2)过程Ⅱ加入过量H2O2把Fe2+被过氧化氢氧化为Fe3+,反应的离子方程式是2Fe2++ H2O2+2H+=2Fe3++ 2H2O。加入伯胺-煤油对浸取液进行分离,Fe(NH2-R)3(OH)SO4进入煤油层,该操作的名称是萃取、分液。
(3)加入NaCl溶液,发生反应Fe3++6Cl-![]() [FeCl6]3-,Cl-结合Fe3+,Fe3+浓度减小,促使3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-,Cl-结合Fe3+,Fe3+浓度减小,促使3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+平衡逆向移动,实现反萃取。
Fe(NH2-R)3(OH)SO4+H+平衡逆向移动,实现反萃取。
(4)4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,该反应中Fe元素化合价由+3降低为+2,[FeCl6]3-是氧化剂,N元素化合价由-2升高为0,N2H4是还原剂,氧化剂与还原剂的物质的量之比为4:1。
(5)电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:第一步:Fe2O3+3H2O+6e-=2Fe+6OH-,第二步:2Fe+N2+3H2O=Fe2O3+2NH3。阴极反应为N2+6H2O+6e-=2NH3+6OH-;阳极反应是4OH--4e-=2H2O+O2,根据电子守恒,该电解池发生总反应的化学方程式为2N2+6H2O![]() 2NH3+3O2,总反应没有消耗纳米Fe2O3,所以纳米Fe2O3在电解过程中所起的作用是催化剂。
2NH3+3O2,总反应没有消耗纳米Fe2O3,所以纳米Fe2O3在电解过程中所起的作用是催化剂。
(6)化学式通式为KxFeO2,根据化合价代数和等于0,设Fe3+为y个,则Fe2+为(1-y)个,若x平均值为1.3,1.3×1+3y+2(1-y)-2×2=0,y=0.7,则磁流体中Fe3+和Fe2+的质量之比为0.7:0.3=7:3。

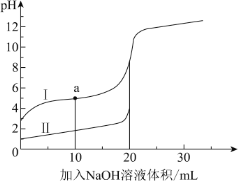
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
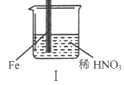
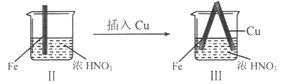
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化