题目内容
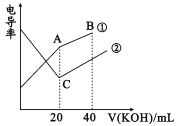
【题目】室温时,向 20 mL 0.1 mol·L 1 的两种酸 HA、HB 中分别滴加0.1 mol·L 1 NaOH 溶液, 其 pH 变化分别对应下图中的 I、II。下列说法不正确的是( )
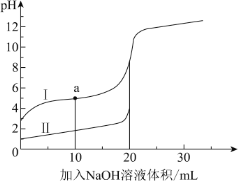
A.向 NaA 溶液中滴加 HB 可产生 HA
B.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-)
C.a 点,溶液中微粒浓度:c(A-) > c(Na+)
D.滴加 20 mL NaOH 溶液时,I 中 H2O 的电离程度大于 II 中
【答案】B
【解析】
A. 由图可知,0.1 mol·L1 HB溶液的pH小于等浓度的HA溶液,说明HB的酸性强于HA,由强酸制弱酸的原理可知,向NaA 溶液中滴加 HB 可产生 HA,A正确;
B. 由于HB的酸性强于HA,等浓度的HB溶液和HA溶液中,滴加NaOH溶液 pH=7 时,消耗NaOH溶液的体积不同,溶液中c(Na+)不同,则两种溶液中 c(A-)一定不等于c(B-),B错误;
C. a点为等浓度的HA和NaA混合液,溶液呈酸性,说明HA的电离大于NaA的水解,溶液中微粒浓度:c(A-)>c(Na+),C正确;
D. 滴加 20 mL NaOH 溶液时,等浓度的HB溶液和HA溶液均恰好完全反应生成NaB和NaA,由于HB的酸性强于HA,则NaA的水解程度大于NaB,Ⅰ中H2O的电离程度大于Ⅱ中,D正确;
故答案为B。

【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示,下列关系不正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
A.酸性:H2CO3>![]()
B.水电离产生的c(H+):①=②
C.溶液③中:c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1molL﹣1
D.溶液④中:c(Na+)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
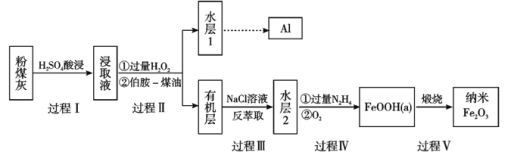
【题目】近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)
H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_________________________________。
(2)为提高CH3OH产率,理论上应采用的条件是_______________________(填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X 平衡转化率变化曲线。

① 反应物X 是_____(填“CO2”或“H2”)。
② 判断依据是_____。
(4)250℃、在体积为 2.0L 的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min 时反应达到平衡,测得 c(CH3OH) = 0.75 mol·L-1。
① 前 10min 的平均反应速率 v(H2)=_____mol·L-1·min-1。
② 经计算化学平衡常数 K =_____________________。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO 纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO 纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO 纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO 纳米片 | 12.0 | 70.6 |
(注:甲醇选择性是指的是转化的CO2中生成甲醇的百分含量)
根据上表所给数据,用CO2生产甲醇的最优选项为_____(填字母)。