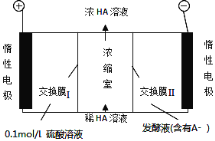
题目内容
【题目】有下列各组物质:(A)O2和O3;(B)23592U和23892U;(C) CH3CH2CH2CH3和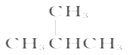 ;(D)
;(D) 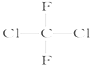 和
和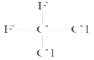 ;(E)甲烷和新戊烷。
;(E)甲烷和新戊烷。
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体。
【答案】B A E C
【解析】
(A)O2和O3 都是由氧元素组成的不同单质,互为同素异形体;
(B)![]() 和
和![]() 都是U元素的不同核素,互为同位素;
都是U元素的不同核素,互为同位素;
(C)CH3CH2CH2CH3和(CH3)2CHCH3 分子式相同,碳链结构不同,互为同分异构体;
(D)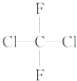 和
和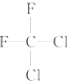 都代表二氟二氯甲烷,为同一种物质;
都代表二氟二氯甲烷,为同一种物质;
(E)甲烷和新戊烷结构相似,分子组成上相差4个-CH2,互为同系物;
则:(1)互为同位素的是B;(2)互为同素异形体的是A;(3)互为同系物的是E;(4)互为同分异构体的是C。

练习册系列答案
相关题目
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()