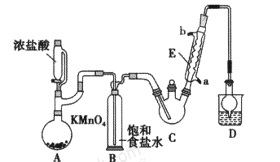
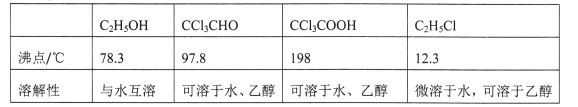
题目内容
【题目】工业上通常采取CO(g)和H2(g)合成CH3OH(g)
(1)已知某温度和压强下
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
③2CH2OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
则在相同温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式__________。若反应生成6.4g甲醇,则转移电子的物质的量为__________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
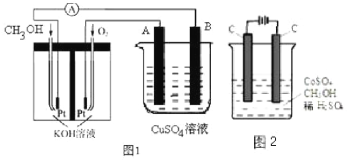
①写出燃料电池负极的电极反应式__________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是__________极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为__________L。
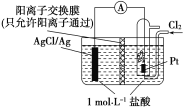
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后将甲醇氧化成CO2和H+(用石墨烯除去Co2+)现用如图2所示装置模拟上述过程,则Co2+在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
【答案】CO(g)+2H2(g)![]() CH3OH(g)△H=-128.8 kJ/mol 0.8mol CH3OH-6e-+8OH-=CO32-+6H2O B 1.12 Co2+-e-=Co3+ 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
CH3OH(g)△H=-128.8 kJ/mol 0.8mol CH3OH-6e-+8OH-=CO32-+6H2O B 1.12 Co2+-e-=Co3+ 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
【解析】
(1)已知:
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
③2CH2OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
根据盖斯定律:①×1/2+②-③得:CO(g)+2H2(g)![]() CH3OH(g)△H=-128.8 kJ/mol;
CH3OH(g)△H=-128.8 kJ/mol;
若反应生成6.4g甲醇,甲醇的物质的量是6.4g÷32g/mol=0.2mol,反应中碳元素化合价从+2价降低到-2价,得到4个电子,则转移电子的物质的量为0.8mol。
(2)①用Pt作电极材料,用氢氧化钾溶液作电解质溶液,由于原电池中负极发生失去电子的氧化反应,因此甲醇在负极失电子在碱溶液中生成盐,负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件做电解池的阴极,阴极与电源负极连接,装置图中与甲醇相连的B电极是阴极;当铁件的质量增重6.4g即0.1mol铜时,根据Cu2++2e-=Cu可知电子转移0.2mol,燃料电池中消耗氧气的电极反应为O2+2H2O+4e-=4OH-,依据电子守恒计算消耗氧气物质的量0.05mol,标准状况下体积=0.05mol×22.4L/mol=1.12L;
(3)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,反应的离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。

 名校课堂系列答案
名校课堂系列答案【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3, | 溶液呈红色 | 稀HNO3将Fe氧化为 |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |