题目内容
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液中离子浓度大小顺序为____________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=____________。
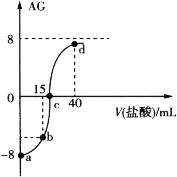
(3)已知纯水中存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
a.向水中加入NaHSO4固体
b.向水中加Na2CO3固体
c.加热至100 ℃其中c(H+)=1×10-6 mol·L-1
d.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
【答案】c(Cl-)>c(NH4+)>c(H+)>c(OH-) 10-3 mol·L-1 10-11 mol·L-1 d <
【解析】
(1)NH4Cl为强酸弱碱盐,铵根离子水解呈酸性;
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸电离抑制水的电离;
(3)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离,据此分析解答。
(1)氯化铵为强酸弱碱盐,水解后溶液呈酸性,铵根离子水解的离子方程式为NH4++H2OH++NH3H2O,铵根离子水解,则c(Cl-)>c(NH4+),所以溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(OH-)=10-3mol/L,c(H+)=![]() mol/L=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L,故答案为:10-3mol/L;10-11mol/L;
mol/L=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L,故答案为:10-3mol/L;10-11mol/L;
(3)a.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,H2O![]() H++OH-平衡向左移动,故a错误;b.向水中加Na2CO3固体,水解后溶液呈碱性,故b错误;c.加热至100℃,促进水的电离,溶液呈中性,故c错误;d.向水中加入(NH4)2SO4固体,铵根离子水解,促进水的电离,H2O
H++OH-平衡向左移动,故a错误;b.向水中加Na2CO3固体,水解后溶液呈碱性,故b错误;c.加热至100℃,促进水的电离,溶液呈中性,故c错误;d.向水中加入(NH4)2SO4固体,铵根离子水解,促进水的电离,H2O![]() H++OH-平衡向右移动,溶液呈酸性,故d正确;故答案为:d;
H++OH-平衡向右移动,溶液呈酸性,故d正确;故答案为:d;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水进行稀释,故答案为:<。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+ |
可能大量含有的阴离子 | Cl-、CO32- |
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)
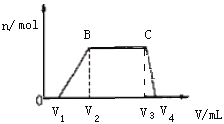
(1)该溶液中一定不含有的离子是___。
(2)V1、V2、V3、V4之间的关系___。
(3)V3V4段离子方程式为___。
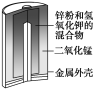
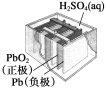
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag