题目内容
【题目】(1)有①分液漏斗②量筒③容量瓶,使用前需检查是否漏液的是___(填序号)
(2)___molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)标准状况下的四种气体:①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是___(填序号)
(4)10mL的CaCl2溶液里含2gCa2+,从中取出一半的溶液中Cl-的物质的量浓度是___。
(5)在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,a和b的关系是___。
(6)某物质A加热时按化学方程式2A=2B+C+3D分解,产物均为气体,测得由生成物组成的混合气体对H2的相对密度为20,则反应物A的摩尔质量为___。
(7)下列物质中:①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠。
属于电解质的是___, 非电解质的是___。
【答案】①③ 3 ② 10mol/L 2a-b=0.2 120g/mol ②⑦⑧ ③⑥
【解析】
(1)若分液漏斗漏液,则会导致使用时液体沿漏斗颈流出;若容量瓶瓶塞与瓶口间漏液,则会造成定容时有液体流出。
(2)利用O原子守恒,则n(H2O)= 1.5mol×2,从而求出n(H2O)。
(3)标准状况下,气体的密度之比等于其相对分子质量之比,比较四种气体的相对分子质量,即可确定密度最大的气体。
(4)c(Cl-)=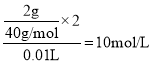 ,从中取出一半的溶液中Cl-的物质的量浓度不变。
,从中取出一半的溶液中Cl-的物质的量浓度不变。
(5)利用电荷守恒,可求出a和b的关系。
(6)由生成物组成的混合气体对H2的相对密度为20,则生成物的平均相对分子质量为20×2=40,可假设反应物为2mol,则生成物为6mol,利用分解前后质量相等建立等量关系式,从而求出反应物A的摩尔质量。
(7)属于电解质的是酸、碱、盐, 属于非电解质的是非金属氧化物和氮的氢化物。
(1)分液漏斗的活塞处,容量瓶的瓶塞与瓶口处都可能漏液,所以需检查是否漏液的仪器是①③。答案为:①③;
(2)利用O原子守恒,n(H2O)= 1.5mol×2,则n(H2O)=3mol。答案为:3;
(3)标准状况下,气体的密度之比等于其相对分子质量之比,四种气体的相对分子质量分别为①CH4,16,②HCl,36.5,③H2S,34,④NH3,17。HCl的相对分子质量最大,即可确定密度最大的气体是②。答案为:②;
(4)10mL的CaCl2溶液里含2gCa2+,c(Cl-)=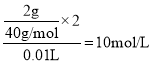 ,从中取出一半的溶液中Cl-的物质的量浓度仍为10mol/L。答案为:10mol/L;
,从中取出一半的溶液中Cl-的物质的量浓度仍为10mol/L。答案为:10mol/L;
(5)在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,利用电荷守恒,可得出2a=0.2+b。答案为:2a-b=0.2;
(6)由生成物组成的混合气体对H2的相对密度为20,则生成物的平均相对分子质量为20×2=40,可假设反应物为2mol,则生成物为6mol,利用质量守恒可得出2mol×M(A)=6mol×40g/mol,从而求出M(A)= 120g/mol。答案为:120g/mol;
(7)在①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠中,②⑦⑧都是纯净的盐,属于电解质;③⑥为纯净的非金属氧化物和氮的氢化物,属于非电解质。答案为:②⑦⑧;③⑥。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案