题目内容
11.下列化合物分子中,在核磁共振氢谱图中能给出二种信号的是( )| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
分析 核磁共振氢谱中峰值数等于有机物中氢原子的种类数;核磁共振氢谱中给出两种峰,说明该分子中的H原子都是等效的,只有2种H原子.
解答 解:A.CH3CH2CH3中有2种H原子,核磁共振氢谱中有2个峰,故A正确;
B.CH3COCH2CH3有3种H原子,核磁共振氢谱中有3个峰,故C错误;
C.CH3CH2OH分子中有3种H原子,核磁共振氢谱中有3个峰,故C错误;
D.CH3COCH3有1种H原子,核磁共振氢谱中有1个峰,故D错误;
故选A.
点评 本题考查核磁共振氢谱的应用,题目难度中等,注意明确核磁共振氢谱中吸收峰的含义.

练习册系列答案
相关题目
1.下列物质沸点的比较,错误的是( )
| A. | 丙烷>乙烷 | B. | 丁烷>乙醇 | C. | 苯酚>苯 | D. | 1-氯丙烷>丙烷 |
2.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |
19.下列化合物中既有离子键又有极性键的是( )
| A. | MgBr2 | B. | NaOH | C. | K2O2 | D. | H2O2 |
3.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中压强随时间变化如图2.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了还原(填“氧化”或“还原”)反应,其电极反应式是O2+2H2O+4e-=4OH-.
(3)经过相当长的一段时间,图1锥形瓶中混合物表面生成了一层红棕色的铁锈,取少量铁锈于试管中,加入稀盐酸,取少量反应之后的溶液检验其中的Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水.

(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(3)经过相当长的一段时间,图1锥形瓶中混合物表面生成了一层红棕色的铁锈,取少量铁锈于试管中,加入稀盐酸,取少量反应之后的溶液检验其中的Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量该FeCl3溶液和过量(填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗(填仪器)中,倒入一定量的CCl4,塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |

20.现有三组混合液:①硝基苯和氢氧化钠溶液 ②苯和甲苯 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
1.下列装置能组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
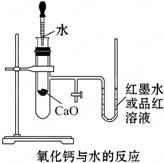 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:①按图所示将实验装置连接好,②在U形管内加入少量红墨水,打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞,③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:①按图所示将实验装置连接好,②在U形管内加入少量红墨水,打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞,③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.