题目内容
6. 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:①按图所示将实验装置连接好,②在U形管内加入少量红墨水,打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞,③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:①按图所示将实验装置连接好,②在U形管内加入少量红墨水,打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞,③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.试回答:
(1)实验前必须进行的一步实验操作是检查装置气密性.
(2)实验中观察到的现象是U形管里的液体左边下降,右边上升.
(3)该实验的原理是CaO和H2O反应放出热量使大试管中的空气受热膨胀,引起红墨水在U形管中的位置左低右高.
(4)请说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:1molCaO和1molH2O的能量和大于1molCa(OH)2的能量.
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象?否.(填“能”或“否”)
分析 (1)由于气压原因导致的实验现象一定要保证装置不漏气;
(2)根据实验所用药品的性质以及气体热胀冷缩的性质来回答;
(3)CaO和水反应的化学反应生成Ca(OH)2;
(4)根据反应物总能量和生成物总能量之间的大小关系决定反应的吸放热情况;
(5)氯化钠和水混合后,能量的变化很不明显.
解答 解:(1)该实验是由于气压原因导致的实验现象出现,所以实验之前一定要检查装置气密性,故答案为:检查装置气密性;
(2)CaO和水反应放出热量,使大试管中空气膨胀,内部压强增大,导致U形管里的液体左边下降,右边上升,故答案为:U形管里的液体左边下降,右边上升;
(3)CaO和水反应生成氢氧化钙,反应的化学反应方程式为:CaO+H2O═Ca(OH)2,反应放出热量使大试管中的空气受热膨胀,引起红墨水在U形管中的位置左低右高,
故答案为:CaO和H2O反应放出热量使大试管中的空气受热膨胀,引起红墨水在U形管中的位置左低右高;
(4)CaO+H2O═Ca(OH)2,根据实验现象知道:氧化钙和水之间的反应是放热的,1 mol CaO和1 mol H2O的能量和大于1 mol Ca(OH)2的能量,
故答案为:1 mol CaO和1 mol H2O的能量和大于1 mol Ca(OH)2的能量;
(5)氯化钠和水混合后,几能量的变化很不明显,试管内气体压强几乎不变,不会出现任何现象,故答案为:否.
点评 本题考查了探究吸热反应与放热反应,题目难度中等,注意知识的迁移和应用是关键,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.AgCl(s)?Ag++Cl-,平衡时[Ag+][Cl-]=Ksp,过量氯化银分别投入①100mL水 ②24mL0.1mol•L-1NaCl ③10mL 0.1mol•L-1MgCl2 ④30mL 0.1mol•L-1AgNO3溶液中,溶液中[Ag+]从大到小顺序( )
| A. | ③①②④ | B. | ④①②③ | C. | ①②③④ | D. | ④③②① |
14.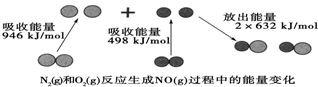 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量大于2mol NO(g)具有的总能量 |
11.下列化合物分子中,在核磁共振氢谱图中能给出二种信号的是( )
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
18.下列说法中不正确的是( )
| A. | 氨气极易溶于水,所以它是农业上常用的氮肥 | |
| B. | 工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定 | |
| C. | 大型中央空调的致冷剂可用液氨 | |
| D. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 |
15.如表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,能表明同一规律的实验还有1和2(填实验序号);
(2)本实验中影响反应速率的除了浓度还有反应温度,仅表明该因素对反应速率产生影响的实验有6和7(填实验序号).
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,能表明同一规律的实验还有1和2(填实验序号);
(2)本实验中影响反应速率的除了浓度还有反应温度,仅表明该因素对反应速率产生影响的实验有6和7(填实验序号).
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
16.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理.某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:

下列判断无法确定的是( )

下列判断无法确定的是( )
| A. | PAFC因水解而能净水 | |
| B. | 往甲溶液中滴入KSCN溶液后呈血红色 | |
| C. | 试剂X具有氧化性 | |
| D. | 乙溶液呈酸性 |
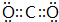 ,BA2分子中化学键属于共价键..
,BA2分子中化学键属于共价键.. .
.