题目内容
9.下列物质中,分子数目最多的是( )| A. | 2molCl2 | B. | 3.01×1023个氧分子 | ||
| C. | 2g氢气 | D. | 标准状况下,11.2LHe |
分析 利用题给条件计算各物质的物质的量,物质的量越多,所含有的分子数越多.
解答 解:A、2molCl2含分子数为2NA;
B、O2分子物质的量=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol 即分子数为0.5NA;
C、2g氢气物质的量为1mol,分子数为NA;
D、标准状况下11.2LHe的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5Mol,即分子数为0.5NA;
故选A.
点评 本题考查了阿伏伽德罗常的应用,重点需要掌握物质的量与质量、微粒数、气体体积的换算关系,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
3.将浓度为0.1mol/LHF溶液加水不断稀释,下列各量始终保持增大的是( )
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{c({F}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+})}{c(HF)}$ |
20. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )
①盐酸、Na2CO3溶液
②Cl2、Fe
③CO2、Ca(OH)2溶液
④NaOH溶液、AlCl3溶液
⑤偏铝酸钠溶液、盐酸
⑥氯化钙溶液、CO2
⑦钠、氧气.
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )①盐酸、Na2CO3溶液
②Cl2、Fe
③CO2、Ca(OH)2溶液
④NaOH溶液、AlCl3溶液
⑤偏铝酸钠溶液、盐酸
⑥氯化钙溶液、CO2
⑦钠、氧气.
| A. | ①②③④ | B. | ①③④⑤ | C. | ③④⑤⑦ | D. | ③④⑤⑥ |
17.设NA为阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 1molCaC2中含有阴离子数目为2NA | |
| B. | 向FeI2溶液中通入氯气,当有2molFe2+被氧化时,转移电子的数目为2NA | |
| C. | 2.8g乙烯与丙烯的混合物中含碳原子的数目为0.4NA | |
| D. | 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移电子数目为8NA |
4.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 溴水溶液:Na+、K+、NO3-、CH3CHO | |
| B. | 氢氧化钠溶液:AlO2-、K+、Cl-、NO3- | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Cl- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、CH3CH2OH |
14.下列说法正确的是( )
| A. | 在同温同压下,22.4L的任何气体都是1 mol | |
| B. | 1molCaCl2完全溶于水后,可以得到1 mol Ca2+和2 mol Cl- | |
| C. | 在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol | |
| D. | 将80g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度是2 mol/L |
1.向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42-)时,溶液的pH( )
| A. | 大于7 | B. | 等于7 | C. | 小于7 | D. | 无法判断 |
18.下列各组性质比较中,正确的是( )
①沸点:HF>HCl>HBr>HI
②离子还原性:S2->Cl->Br->I-
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2->F->Na+>Mg2+.
①沸点:HF>HCl>HBr>HI
②离子还原性:S2->Cl->Br->I-
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2->F->Na+>Mg2+.
| A. | ①②③ | B. | ③④⑤⑥ | C. | ②③④ | D. | ①③④⑤⑥ |
19.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
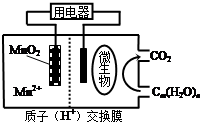

| A. | 分子组成为Cm (H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2 O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm (H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g |