题目内容
1.向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42-)时,溶液的pH( )| A. | 大于7 | B. | 等于7 | C. | 小于7 | D. | 无法判断 |
分析 当溶液中c(NH4+)=2c(SO42-)时,根据电荷守恒c(NH4+)+c(H+)=2c(SO42-)+c(OH-)可知溶液中一定满足:c(H+)=c(OH-),则混合液显示中性,溶液的pH=7.
解答 解:向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42-)时,根据电荷守恒c(NH4+)+c(H+)=2c(SO42-)+c(OH-)可得:c(H+)=c(OH-),混合溶液呈中性,所以溶液的pH=7,
故选B.
点评 本题考查了溶液pH的简单计算,题目难度不大,明确电荷守恒为解答关键,注意掌握溶液酸碱性与溶液pH的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.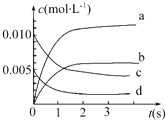 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%.
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)、铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
①工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
②工作时,电解质溶液的pH值增大(“增大”、“减小”或“不变”)
③工作时,电解质溶液中阴离子移向负极.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652kJ的热量.
①反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
③发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
肼和二氧化氮反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)、铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
①工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
②工作时,电解质溶液的pH值增大(“增大”、“减小”或“不变”)
③工作时,电解质溶液中阴离子移向负极.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652kJ的热量.
①反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
③发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
肼和二氧化氮反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1.
12.下列实验操作中正确的是( )
| A. | 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球插入蒸馏烧瓶中液体的液面以下 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 称量时,称量物放在托盘天平的右盘,砝码放在托盘天平的左盘 |
9.下列物质中,分子数目最多的是( )
| A. | 2molCl2 | B. | 3.01×1023个氧分子 | ||
| C. | 2g氢气 | D. | 标准状况下,11.2LHe |
16.能使合成氨反应进行程度增大的方法是( )
| A. | 升高温度 | B. | 降低压强 | C. | 使用催化剂 | D. | 及时分离出氨气 |
6.下列离子:①SO${\;}_{3}^{2-}$ ②S2- ③HCO${\;}_{3}^{-}$ ④CO${\;}_{3}^{2-}$ ⑤SO${\;}_{4}^{2-}$ ⑥I- ⑦NH${\;}_{4}^{+}$ ⑧SiO${\;}_{3}^{2-}$ ⑨Fe2+ ⑩Cl-,其中能在稀H2SO4溶液中能大量存在的是( )
| A. | ①②③④⑥⑧⑨ | B. | ⑤⑥⑦⑩ | C. | ⑤⑥⑦⑨⑩ | D. | ⑤⑦ |
13.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g•cm-3,这种氨水的物质的量浓度为( )
| A. | 18.4mol | B. | 18.4mol•L-1 | C. | 20.4 | D. | 20.4mol•L-1 |
10.等物质的量的N2、O2、CO2 混合气体通过Na2O2 后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2 物质的量之比为( )
| A. | 3:4:1 | B. | 3:3:2 | C. | 6:7:3 | D. | 6:9:0.5 |