题目内容
17.设NA为阿伏加德罗常数的值.下列说法中正确的是( )| A. | 1molCaC2中含有阴离子数目为2NA | |
| B. | 向FeI2溶液中通入氯气,当有2molFe2+被氧化时,转移电子的数目为2NA | |
| C. | 2.8g乙烯与丙烯的混合物中含碳原子的数目为0.4NA | |
| D. | 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移电子数目为8NA |
分析 A、CaC2由钙离子和C22-构成;
B、根据碘离子和亚铁离子都能够被氯气氧化且先氧化碘离子再氧化亚铁离子分析;
C、乙烯和丙烯的最简式均为CH2;
D、根据四氧化三铁和转移电子之间的关系计算.
解答 解:A、CaC2由钙离子和C22-构成,故1molCaC2中含1molC22-即NA个,故A错误;
B、FeI2溶液中,碘离子的还原性大于亚铁离子的,通入适量氯气,当有2molFe2+被氧化时,溶液中碘离子已经完全被氧化,由于不知道碘化亚铁的物质的量,无法计算转移的电子数,故B错误;
C、乙烯和丙烯的最简式均为CH2,故2.8g混合物中含有的CH2的物质的量n=$\frac{2.8g}{14g/mol}$=0.2mol,则含0.2NA个碳原子,故C错误;
D、Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+ 4CO2 转移电子
1mol 8mol
1mol 8mol
所以还原1molFe3O4转移电子8mol,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
8.乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图1、化学反应式和有关数据如表:
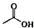 +
+ $\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$
$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ +H2O
+H2O
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是:球形冷凝管;
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率;
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在图2蒸馏操作中,仪器选择及安装都正确的是:b(填标号);
(7)本实验的产率是:c;A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.

 +
+ $\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$
$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是:球形冷凝管;
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率;
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在图2蒸馏操作中,仪器选择及安装都正确的是:b(填标号);
(7)本实验的产率是:c;A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.

5.如图所示的家庭小实验中,主要发生物理变化的是( )
| A. |  生成炭黑的实验 | B. |  净水 | ||
| C. | 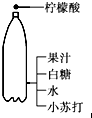 自制汽水 | D. |  将鸡蛋壳放入醋中 |
12.下列实验操作中正确的是( )
| A. | 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球插入蒸馏烧瓶中液体的液面以下 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 称量时,称量物放在托盘天平的右盘,砝码放在托盘天平的左盘 |
2.恒温下,下列情景中最终不能析出固体的是( )
| A. | 将CO2持续通入NaCl和NH3均达饱和的混合溶液中 | |
| B. | 将CO2持续通入饱和Na2CO3溶液中 | |
| C. | 将少量SO2通入NH3和BaCl2的混合溶液中 | |
| D. | 将NH3持续通入AgNO3溶液中 |
9.下列物质中,分子数目最多的是( )
| A. | 2molCl2 | B. | 3.01×1023个氧分子 | ||
| C. | 2g氢气 | D. | 标准状况下,11.2LHe |
6.下列离子:①SO${\;}_{3}^{2-}$ ②S2- ③HCO${\;}_{3}^{-}$ ④CO${\;}_{3}^{2-}$ ⑤SO${\;}_{4}^{2-}$ ⑥I- ⑦NH${\;}_{4}^{+}$ ⑧SiO${\;}_{3}^{2-}$ ⑨Fe2+ ⑩Cl-,其中能在稀H2SO4溶液中能大量存在的是( )
| A. | ①②③④⑥⑧⑨ | B. | ⑤⑥⑦⑩ | C. | ⑤⑥⑦⑨⑩ | D. | ⑤⑦ |
7.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1 AlC13溶液中:H+、Na+、Cl-、NO3- | |
| B. | 含有0.1mol•L-1 Fe3+的溶液中:Na+、K+、SCN-、SO42- | |
| C. | c(H+)=0.1 mol•L-1的溶液:Na+、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、S2O${\;}_{3}^{2-}$ | |
| D. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |