题目内容
18.下列各组性质比较中,正确的是( )①沸点:HF>HCl>HBr>HI
②离子还原性:S2->Cl->Br->I-
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2->F->Na+>Mg2+.
| A. | ①②③ | B. | ③④⑤⑥ | C. | ②③④ | D. | ①③④⑤⑥ |
分析 ①HF中含氢键,沸点最高,其它氢化物中相对分子质量大的沸点高;
②元素的非金属性越强,对应离子还原性越弱;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④根据元素周期律确定金属的活泼性;
⑤元素的非金属性越强,气态氢化物稳定性越强;
⑥电子层越多,半径越大,电子层一样,核电荷数越多,半径越小.
解答 解:①HF中含氢键,沸点最高,其它氢化物中相对分子质量大的沸点高,则沸点为HF>HI>HBr>HCl,故错误;
②元素的非金属性Cl>Br>I>S,对应离子还原性S2->I->Br->Cl-,故错误;
③非金属性Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,即酸性:HClO4>HBrO4>HIO4,故正确;
④同主族行上到下,金属性增强:K>Na,同周期,从左到右金属性减弱,即Na>Mg>Al,即金属性:K>Na>Mg>Al,故正确;
⑤元素的非金属性F>Cl>S,气态氢化物稳定性HF>HCl>H2S,故正确;
⑥电子层越多,半径越大,电子层一样,核电荷数越多,半径越小,即O2->F->Na+>Mg2+,故正确.
故选B.
点评 本题考查较为综合,涉及元素非金属性、非金属性、沸点,微粒半径大小、氢化物稳定性等知识,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律,难度中等,学习中注意积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图1、化学反应式和有关数据如表:
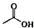 +
+ $\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$
$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ +H2O
+H2O
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是:球形冷凝管;
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率;
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在图2蒸馏操作中,仪器选择及安装都正确的是:b(填标号);
(7)本实验的产率是:c;A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.

 +
+ $\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$
$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是:球形冷凝管;
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率;
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在图2蒸馏操作中,仪器选择及安装都正确的是:b(填标号);
(7)本实验的产率是:c;A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.

9.下列物质中,分子数目最多的是( )
| A. | 2molCl2 | B. | 3.01×1023个氧分子 | ||
| C. | 2g氢气 | D. | 标准状况下,11.2LHe |
6.下列离子:①SO${\;}_{3}^{2-}$ ②S2- ③HCO${\;}_{3}^{-}$ ④CO${\;}_{3}^{2-}$ ⑤SO${\;}_{4}^{2-}$ ⑥I- ⑦NH${\;}_{4}^{+}$ ⑧SiO${\;}_{3}^{2-}$ ⑨Fe2+ ⑩Cl-,其中能在稀H2SO4溶液中能大量存在的是( )
| A. | ①②③④⑥⑧⑨ | B. | ⑤⑥⑦⑩ | C. | ⑤⑥⑦⑨⑩ | D. | ⑤⑦ |
13.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g•cm-3,这种氨水的物质的量浓度为( )
| A. | 18.4mol | B. | 18.4mol•L-1 | C. | 20.4 | D. | 20.4mol•L-1 |
10.等物质的量的N2、O2、CO2 混合气体通过Na2O2 后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2 物质的量之比为( )
| A. | 3:4:1 | B. | 3:3:2 | C. | 6:7:3 | D. | 6:9:0.5 |
7.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1 AlC13溶液中:H+、Na+、Cl-、NO3- | |
| B. | 含有0.1mol•L-1 Fe3+的溶液中:Na+、K+、SCN-、SO42- | |
| C. | c(H+)=0.1 mol•L-1的溶液:Na+、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、S2O${\;}_{3}^{2-}$ | |
| D. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |